Introducción
Los tiburones han existido durante 420 millones de años—sobreviviendo, por lo menos, a cuatro extinciones masivas—, y esto los hace más antiguos que los árboles. Debido a su larga presencia en el planeta, hoy en día podemos encontrar 537 especies de tiburones en el mundo (Serena et al., 2020). No obstante, enfrentan un escenario crítico, en el que la demanda por su carne y aletas los está empujando al borde del colapso.
Los países vienen tomando medidas a nivel interno —vedas, cuotas de pesca— y externo, y un ejemplo de este último es la existencia de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (Cites), la cual ayuda a regular el comercio de dichas especies. Debido a que los tiburones tienen múltiples roles ecológicos que favorecen la integridad y salud de los océanos, su extinción afectaría negativamente a los ecosistemas marinos y a todos los seres vivos que dependen de ellos, incluidos los humanos.
Actualmente, los tiburones son la base de importantes pesquerías a nivel global. Estos son capturados en 135 países y su comercio representó alrededor de US$ 1 000 millones a nivel internacional en el año 2011 (Dulvy et al., 2017). Asimismo, estos peces son muy importantes para el turismo, donde se calcula que contribuyen con US$ 314 millones anuales (Cisneros-Montemayor et al., 2013). El turismo de avistamiento de tiburones se centra en unas pocas especies —solamente 18—, mientras que su extracción involucra a más de un centenar (Dulvy et al., 2017).
Lamentablemente, los tiburones constituyen uno de los grupos de peces más amenazados en la actualidad (Dulvy et al., 2017). El motivo radica en que muchas veces las pesquerías que los aprovechan no son compatibles con sus historias de vida: baja productividad, maduración tardía y crecimiento lento (PEW, 2012; Shiffman y Hammerschlag, 2016). Esto, unido a un gran vacío de información acerca del estado poblacional de la mayoría de especies de tiburones, deriva en una gran preocupación global.
Pese a que varias de sus especies han visto sus poblaciones reducidas considerablemente (Baum et al., 2003; Baum y Myers, 2004), los tiburones han recibido poca o nula atención por parte de científicos y personalidades responsables de toma de decisiones (McAllister et al., 2008). Esta situación ha sido alimentada por la idea de que una pesquería sostenible de tiburones es imposible (Simpfendorfer y Dulvy, 2017), así como por el hecho de que muchas personas tienen actitudes negativas hacia estos peces (Simpfendorfer et al., 2011).
Tiburones y ancestros peruanos
|
La relación entre los tiburones y los ancestros de los peruanos existe hace 10 mil años, aproximadamente, y se mantiene hasta hoy (Prieto, 2015). Se tiene múltiples registros de la importancia de los tiburones para diferentes culturas y comunidades costeras prehispánicas. No solo eran importantes para su seguridad alimentaria, sino también para su espiritualidad, religión y arte. Se sabe que en el sitio arqueológico de Gramalote (1550-1250 a.C., Huanchaquito, La Libertad), donde se tiene uno de los primeros registros de caballitos de totora, el tiburón azul (Prionace glauca) contribuye con hasta 50 % de todos los restos marinos alimenticios encontrados (Prieto, 2015). |
Por otro lado, en la Huaca Pucllana (200-700 d.C.), de la cultura Lima, se puede apreciar el aspecto sagrado de estos peces. Aquí hay evidencia de que la pesca y el consumo de tiburones se destinaba a ocasiones especiales, generalmente asociadas a sacrificios humanos y al uso de la élite (Altamirano-Sierra y Vargas-Nalvarte, 2014). Se ha hallado, además, múltiples ilustraciones de tiburones en cerámicas, textiles y joyería (Prieto, 2015).
En el Perú, existen 66 especies de tiburones, según los últimos estudios publicados (Cornejo et al., 2015; Kelez et al., 2019). Sin embargo, es importante reconocer que este listado merece una revisión y actualización. De dicha cantidad, 31 son categorizadas como De interés comercial (Romero y Bustamante, 2007). No obstante, especies no categorizadas como De interés comercial también son capturadas incidentalmente en las pesquerías peruanas. Las capturas dirigidas de tiburones son principalmente artesanales y de menor escala, pero también se registran significativas capturas incidentales de estos peces en pesquerías de mayor escala, como, por ejemplo, la del atún.
Tanto en el Perú como en todo el mundo, las poblaciones de los tiburones están disminuyendo debido a la sobrepesca, tanto dirigida como incidental. Esto pone su supervivencia en peligro, y, por ello, es necesario establecer medidas de manejo adecuadas para recuperar sus poblaciones a niveles históricos y manejar su pesquería de forma sostenible.
Como parte de los compromisos internacionales asumidos, Perú ha aprobado una serie de medidas que buscan el uso sostenible de los tiburones, como es el caso de tallas mínimas de captura (TMC), prohibiciones de captura para ciertas especies, regulaciones de artes y métodos de pesca, entre otras.
En el Perú, existen 66 especies de tiburones, según los últimos estudios publicados. De dicha cantidad, 31 son categorizados como de interés comercial.
El país cuenta con un Plan de Acción Nacional para la Conservación y Ordenamiento de Tiburones, Rayas y Especies afines en el Perú (PAN Tiburón-PerúPuedes consultar el documento completo del PAN Tiburón-Perú dando click aquí.). Su aprobación responde a la adhesión voluntaria a instrumentos de ordenamiento, como el Plan de Acción Internacional para la conservación y la ordenación de los tiburones (PAI-Tiburones) —propuesto por la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO)— y también al Plan de Acción Regional para la Conservación de Tiburones, Rayas y Quimeras en el Pacífico Sudeste (PAR-CPPS), propuesto por la Comisión Permanente del Pacífico Sur (CPPS) a nivel regional.
El PAN Tiburón-Perú fue elaborado con la finalidad de garantizar la conservación y el ordenamiento pesquero de los tiburones, rayas y especies afines que se encuentren en aguas jurisdiccionales del Perú para su aprovechamiento sostenible.
El estado actual del conocimiento sobre tiburones en Perú
El conocimiento biológico y ecológico que tenemos de los tiburones en Perú es bastante limitado. Este recurso no ha recibido mucha atención en las últimas décadas. Nuestra principal fuente de información son las pesquerías de tiburones y sus desembarques, el seguimiento y monitoreo que realiza el Instituto del Mar del Perú (Imarpe) y algunas investigaciones desarrolladas con observadores a bordo, en algunos puntos de desembarque o mediante salidas de investigación independientes.
Estado de conservación de los tiburones en Perú
De las 66 especies de tiburones registradas en el Perú, según la Lista Roja de Especies Amenazadas de la Unión Internacional para la Conservación de la Naturaleza (UICN), se ha categorizado 11 En peligro crítico (CR), 8 En peligro (EN), 14 en situación Vulnerable (VU), 10 Casi amenazada (NT) y 19 en Preocupación menor (LC). Además, la lista incluye 4 especies que no han podido ser categorizadas, por tener Datos deficientes (DD).
Las cifras presentadas demuestran un preocupante deterioro progresivo de las poblaciones de tiburones en el Perú, pues, hasta antes del año 2019, no había especies categorizadas en Peligro crítico. Actualmente, tenemos al 50 % de nuestras especies en categoría de amenaza (CR, EN y VU). Es importante indicar que las evaluaciones realizadas por la UICN se basan, en su mayoría, en datos provenientes de otros países, por lo que la situación de los stocks a nivel regional podría ser incluso más preocupante. Las especies en Datos deficientes, es decir, que carecen de información suficiente para catalogar su situación poblacional, también causan preocupación debido a que ya podrían encontrarse en una situación de amenaza sin que se conozca y, por ende, sin que se pueda tomar las acciones de recuperación o conservación pertinentes.
En el siguiente cuadro, se presentará las 66 especies de tiburones identificados en el Perú, se indicará su categoría de conservación y tendencia poblacional, su inclusión dentro de convenciones internacionales y la talla mínima de captura permitida a nivel nacional, según la UICN. El estado poblacional de dichas especies se categoriza de acuerdo a la Lista Roja de la UICN, de la siguiente manera:
- CR = En Peligro Crítico
- EN = En Peligro
- VU = Vulnerable
- NT = Casi Amenazada
- LC = Preocupación Menor
- DD = Datos Deficientes
En cuanto a la tendencia poblacional, tenemos la siguiente clasificación:
- DEC = Decreciendo
- INC = Aumentando
- ST = Estable
- UNK = Desconocida
|
LISTADO DE LAS 66 ESPECIES DE TIBURONES REPORTADAS PARA EL PERÚ |
||||||||
|
Nombre científico |
Nombre |
Desembarques registrados |
Estado de conservación |
Régimen legal |
||||
|
UICN |
Internacional |
Nacional |
||||||
|
Evaluación |
Categoría |
Tendencia |
Cites |
CMS |
TMC (cm) |
|||
| Familia Hexanchidae | ||||||||
| Hexanchus griseus | Tiburón de seis agallas | Global | NT | DEC | ||||
| Heptranchias perlo | Tiburón de siete agallas | Global | NT | DEC | ||||
| Notorynchus cepedianus* | Gatita | X | Global | VU | DEC | |||
| Familia Echinorhinidae | ||||||||
| Echinorhinus cookei* | Tiburón negro espinoso | Global | DD | UNK | ||||
| Familia Centrophoridae | ||||||||
| Deania calcea | Tollo pajarito | Global | NT | DEC | ||||
| Familia Etmopteridae | ||||||||
| Aculeola nigra | Tollo negro | Global | NT | DEC | ||||
| Centroscyllium nigrum | Tollo negro peine | Global | LC | STA | ||||
| Familia Somniosidae | ||||||||
| Centroselachus crepidater | Pailona negra | Global | NT | DEC | ||||
| Somniosus pacificus | Tiburón de profundidad | Global | NT | DEC | ||||
| Zameus squamulosus | Bruja terciopelo | Global | LC | STA | ||||
| Familia Dalatiidae | ||||||||
| Isistius brasiliensis | Tiburón puro | Global | LC | UNK | ||||
| Euprotomicrus bispinatus | Tiburón pigmeo | Global | LC | UNK | ||||
| Mollisquama parini | Tiburón mielga suave | Global | DD | STA | ||||
| Familia Squatinidae | ||||||||
| Squatina armata | Angelote | Global | CR | DEC | Ap. I | |||
| Squatina californica* | Angelote | X | Global | NT | DEC | |||
| Familia Heterodontidae | ||||||||
| Heterodontus francisci | Tiburón gato | Global | DD | UNK | ||||
| Heterodontus mexicanus | Tiburón gato | Global | LC | STA | ||||
| Heterodontus quoyi* | Tiburón gato | X | Global | LC | STA | |||
| Familia Ginglymostomatidae | ||||||||
| Ginglymostoma unami** | Tiburón gata | Global | EN | DEC | ||||
| Familia Rhincodontidae | ||||||||
| Rhincodon typus | Tiburón ballena | X | Global | EN | DEC | Ap. II | Ap. I y II | Protegido |
| Familia Pseudocarchariidae | ||||||||
| Pseudocarcharias kamoharai | Tiburón cocodrilo | Global | LC | INC | ||||
| Familia Lamnidae | ||||||||
| Carcharodon carcharias | Gran tiburón blanco | Global | VU | DEC | Ap. II | Ap. I y II | ||
| Isurus oxyrinchus* | Tiburón diamante | X | Global | EN | DEC | Ap. II | Ap. II | 170 |
| Lamna nasus* | Tiburón marrajo o sardinero | X | Global | VU | DEC | Ap. II | Ap. II | |
| Megachasma pelagios | Tiburón boquiancho | Global | LC | UNK | ||||
| Familia Alopiidae | ||||||||
| Alopias superciliosus* | Tiburón zorro ojón | Global | VU | DEC | Ap. II | Ap. II | ||
| Alopias pelagicus* | Tiburrón zorro pelágico | X | Global | EN | DEC | Ap. II | Ap. II | |
| Alopias vulpinus* | Tiburón zorro común | X | Global | VU | DEC | Ap. II | Ap. II | |
| Familia Cetorhinidae | ||||||||
| Cetorhinus maximus | Tiburón peregrino | Global | EN | DEC | Ap. II | Ap. I y II | ||
| Familia Scyliorhinidae | ||||||||
| Apristurus brunneus | Pejegato café | Global | DD | UNK | ||||
| Apristurus kampae | Pejegato trompudo | Global | DD | UNK | ||||
| Apristurus nasutus | Tiburón negro narizón | Global | LC | STA | ||||
| Bythaelurus canescens | Pejegato | Global | VU | DEC | ||||
| Cephalurus cephalus | Tiburón renacuajo | Global | LC | STA | ||||
| Cephaloscyllium ventriosum | Tiburón inflado | Global | LC | UNK | ||||
| Galeus piperatus | Pejegato pimienta | Global | LC | STA | ||||
| Schroederichthys bivius | Tiburón pintaroja | Global | LC | STA | ||||
| Schroederichthys chilensis* | Tollo manchado | X | Global | LC | UNK | |||
| Familia Triakidae | ||||||||
| Mustelus mento* | Tollo con bandas | X | Global | CR | DEC | 60 | ||
| Mustelus whitneyi* | Tollo común, tollo mama | X | Global | CR | DEC | 60 | ||
| Mustelus henlei | Tollo de leche | Global | LC | UNK | ||||
| Mustelus dorsalis* | Tollo blanco | X | Global | VU | DEC | |||
| Mustelus californicus | Tollo | Global | LC | UNK | ||||
| Mustelus lunulatus | Tollo | Global | LC | UNK | ||||
| Galeorhinus galeus* | Tiburón de aleta, cazón | X | Global | CR | DEC | Ap. II | ||
| Triakis maculata* | Tollo manchado | X | Global | CR | DEC | 60 | ||
| Triakis acutipinna | Tollo de Ecuador | Global | EN | DEC | ||||
| Familia Carcharhinidae | ||||||||
| Carcharhinus brachyurus* | Tiburón mantequero | X | Global | VU | DEC | ** | 150 | |
| Carcharhinus falciformis* | Tollo mantequero | Global | VU | DEC | Ap. II | Ap. II | 150 | |
| Carcharhinus limbatus* | Tiburón puntas negras | X | Global | VU | DEC | ** | 150 | |
| Carcharhinus porosus* | Cuero duro | X | Global | CR | DEC | ** | 150 | |
| Carcharhinus longimanus* | Tiburón puntas blancas | Global | CR | DEC | Ap. II | Ap. I | 150 | |
| Carcharhinus leucas* | Tiburón toro / Cazón | Global | VU | DEC | ** | 150 | ||
| Carcharhinus altimus* | Cazón | Global | NT | DEC | ** | 150 | ||
| Carcharhinus galapagensis* | Cazón | Global | LC | UNK | ** | 150 | ||
| Prionace glauca* | Tiburón azul | X | Global | NT | DEC | ** | Ap. II | 160 |
| Nasolamia velox* | Cazón pico blanco | X | Global | EN | DEC | ** | ||
| Negaprion brevirostris | Tiburón amarillo | Global | VU | DEC | ** | |||
| Rhizoprionodon longurio* | Tiburón hocicón | Global | VU | DEC | ** | |||
| Galeocerdo cuvier* | Tiburón tigre | X | Global | NT | DEC | ** | ||
| Familia Sphyrnidae | ||||||||
| Sphyrna lewini* | Tiburón martillo festonado | Global | CR | DEC | Ap. II | Ap. II | ||
| Sphyrna zygaena* | Tiburón martillo | X | Global | VU | DEC | Ap. II | Ap. II | |
| Sphyrna mokarran* | Gran tiburón martillo | Global | CR | DEC | Ap. II | Ap. II | ||
| Sphyrna corona | Tiburón cabeza de paleta | Global | CR | DEC | ** | |||
| Sphyrna media | Tiburón martillo cuchara | Global | CR | DEC | ** | |||
| Sphyrna tiburo* | Tiburón bonete del Pacífico | Global | EN | DEC | ** | |||
* Especies clasificadas como De importancia comercial.
**Especies que ingresarán al Apéndice II de Cites el 25 de noviembre del 2023.
***Ginglymostoma cirratum es ahora G. unami.
Fuente: Elaboración propia
Actualmente, de las 11 las especies En peligro crítico, ocho son consideradas de importancia comercial, y solo existen datos de desembarque para cinco de ellas. Esta situación dificulta el manejo de las otras especies.
El tiburón puntas blancas (Carcharhinus longimanus) es un caso especial a nivel global, dado que su disminución ya se había evidenciado hace unos años en todos los océanos. Ante esto, se establecieron diversas medidas para mejorar su manejo, como por ejemplo, incluirlo en el Apéndice II de Cites y en el Apéndice I de CMS, así como en otras disposiciones aplicadas en las pesquerías de atunes. Sin embargo, esto no logró impedir que siga disminuyendo. A pesar de que el tiburón pelágico ha sido más abundante en los océanos tropicales del mundo, hoy en día esta especie es raramente observada en algunas regiones. De acuerdo a Rigby et al. (2019), ha disminuido más del 98 % en los últimos 61 años.
El tiburón de aleta (Galeorhinus galeus), a nivel global, se distribuye en seis poblaciones distintas, una de las cuales es la del Pacífico Sur Oriental (desde Ecuador hasta Chile), y comprende a los individuos presentes en el Perú. La evaluación del estado poblacional de esta especie fue realizada en base a información proveniente de tres de las seis poblaciones existentes, y el resultado fue que hay grandes disminuciones que la calificaron en Peligro crítico (Walker et al., 2020). No se cuenta con información del Pacifico Sur Oriental, y, para el Perú, la información de desembarques del Imarpe sobre este tiburón presenta valores muy variables entre años, además de aún no evidenciar una tendencia definida. Es prioritario desarrollar un seguimiento a la población de tiburón de aleta en Perú para determinar en qué estado se encuentra.
El caso del angelote, los tollos y los tiburones martillos es también preocupante. Tres especies de tollos comerciales, que son el tollo común (M. whitneyi), el tollo con bandas (M. mento) y el tollo manchado (Triakis maculata), han visto sus poblaciones desplomarse, siendo el tollo común la cuarta especie de tiburón más desembarcada en el país, además de ser endémica de Ecuador, Perú y Chile. Los martillos en Peligro crítico son el tiburón martillo festonado (Sphyrn lewini), el gran tiburón martillo (S. mokarran), el tiburón martillo cuchara (S. media) y el tiburón cabeza de paleta (S. corona), especies oceánicas que también, debido a su alta captura, han disminuido grandemente en los últimos años. Sobre el angelote, se dará más detalle en la sección 2.2.6.
De las 66 especies de tiburones registradas en el Perú, según la Lista Roja de Especies Amenazadas de UICN, se han categorizado 11 En peligro crítico (CR), 8 En peligro (EN), 14 en situación Vulnerable (VU), 10 Casi amenazada (NT) y 19 en Preocupación menor (LC).
Por otro lado, los angelotes (S. armata) también están en una situación preocupante. Un estudio reciente determinó que, en el norte del Perú, yace la presencia no solo de S. californica y S. armata, sino también de una potencial tercera especie críptica no descrita (Cañedo-Apolaya et al., 2021).
Dentro de las especies clasificadas como En peligro, el tiburón ballena se encuentra protegido en el Perú desde el año 2017, y actualmente se está recabando información sobre su biología y ecología, especialmente en la costa norte (Produce, 2017; Maguiño et al., 2018; Gonzalez-Pestana et al., 2020). Para el caso del tiburón peregrino (Cetorhinus maximus), el tiburón gata (Ginglymostoma unami), el tiburón bonete del Pacífico (Sphyrna tiburo) y el tollo del Ecuador (Triakis acutipinna) la información es casi inexistente e incluso algunas evaluaciones mencionan que el ultimo podría no encontrarse en Perú (Kyne et al., 2021).
El tiburón zorro pelágico (Alopias pelagicus), el cazón pico blanco (Nasolamia velox) y el tiburón diamante (Isurus oxyrinchus) sí cuentan con información sobre sus desembarques, especialmente para el ultimo, dado que, comercialmente, es la segunda especie de tiburones más importante a nivel nacional. Debido a su importancia comercial, es necesario mejorar las medidas de manejo del tiburón diamante, a fin de prevenir futuros declives en sus poblaciones.
Lo mismo se puede decir para las otras dos especies de gran importancia comercial en el Perú que se encuentran en situación Vulnerable: el tiburón martillo (Sphyrna zygaena) y el tiburón zorro común (Alopias vulpinus).
Acceso a información a partir de las especies más importantes de la economía peruana
Tal y como se mencionó al inicio de esta sección, la data que se tiene sobre los tiburones es escasa. Es por ello que la mayor cantidad de información biológica viene de las especies económicamente más importantes y cuyos desembarques son los mayores: tiburón azul, tiburón diamante, tiburón martillo, tollo común, tiburón zorro común y angelote. En este informe también se presenta información de tiburones recientemente estudiados, como el tiburón ballena y el tiburón de aleta.
A continuación, se dará más detalle sobre las especies mencionadas:
Tiburón azul
Prionace glauca es una especie pelágica-oceánica que se distribuye en aguas tropicales y templadas hasta los 1 160 m (Queiroz et al., 2012). Posee reproducción vivípara placentaria, con una fecundidad de hasta 30 embriones. Se ha reportado tallas de madurez sexual a partir de 182 cm en machos y 221 cm en hembras (Castro y Mejuto, 1995), aunque los machos alcanzan mayores tallas que las hembras. Se alimenta principalmente de pequeños peces pelágicos, cefalópodos, crustáceos, tiburones pequeños, cetáceos y aves marinas (Nakano y Stevens, 2008).
En Perú, la información biológica de esta especie proviene de monitoreos realizados durante faenas de pesca o desembarques, al ser la especie más pescada a nivel nacional. Las investigaciones muestran que los machos adultos, cuya talla promedio es de 260 cm, están presentes durante los meses de primavera y verano, y que el resto del año solo se encuentran machos juveniles. En el caso de las hembras, se ha evidenciado una preocupante realidad, pues el 85 % de individuos capturados en la pesquería de palangre no ha alcanzado la talla de primera madurez —su talla mínima promedio es de 106.5 cm— y están presentes todo el año (Elliot et al., 1995, 1996, 1997a, 1997b; Romero y Bustamante, 2007). Estos patrones de machos de mayor tamaño y hembras de talla menor se repiten en aguas ecuatorianas (Briones-Mendoza et al., 2016).
Tiburón diamante
Isurus oxyrinchus es una especie epipelágica que se encuentra en todos los mares tropicales y templados, hasta los 500 m de profundidad y 37° latitud norte y sur, de acuerdo con Fischer et al. (1995). En el Océano Pacífico, se ha estimado que machos de 200 cm de longitud total pueden tener nueve años, mientras que hembras de 290 cm pueden alcanzar los 18 años y que individuos menores de 100 cm aún no cumplen el año de edad (Ribot Carballal et al., 2005). Al parecer, los machos alcanzan la madurez sexual a los 200 o 215 cm de largo total, mientras que las hembras lo hacen entre los 275 o 290 cm (Joung y Hsun Hsu, 2005). En esta especie, las hembras alcanzan mayores tallas que los machos.
Al igual que el tiburón azul, la información biológica del tiburón diamante en Perú proviene de los monitoreos en faenas de pesca o desembarques, al ser la segunda especie más pescada a nivel nacional. Estudios realizados en los años noventa en el norte de Perú muestran que el promedio de los tiburones diamante estaba por encima de la talla mínima legal de captura (170 cm), pero no por encima de la talla de madurez sexual (200 cm para machos y 270 cm para hembras). La mayoría de machos reportados fueron adultos, en tanto que todas las hembras capturadas fueron individuos juveniles (Elliot et al., 1995, 1996, 1997a, 1997b).
Los desembarques de embarcaciones espineleras en la zona centro del Perú muestran un rango de tallas amplio (69-317 cm), lo que significa que se encuentran tanto individuos juveniles como adultos. En el estudio pesquero anual de Romero y Bustamante (2007), la mayoría de individuos observados fueron juveniles, y solo se encontraron algunas hembras adultas en marzo y machos adultos en marzo, abril y julio.
En otros estudios pesqueros, se halló que, tanto hembras como machos capturados por embarcaciones espineleras frente a Ica, Arequipa, Moguegua, Tacna y el norte de Chile, se encontraban por debajo de la talla mínima legal de captura (Romero y Bustamante, 2007 y Doherty et al., 2014). En resumen, la captura de tiburón diamante en Perú está compuesta en su mayoría por individuos juveniles, aunque en la zona norte de Perú ocurre una mayor abundancia de machos adultos.
Es importante mencionar que la talla mínima legal de captura establecida para esta especie es menor que la talla de madurez sexual reportada en estudios científicos. Este desfase representa un problema crítico para la pesca sostenible de esta especie por lo que se recomienda una revisión y actualización de la norma.
Tiburón martillo
Sphyrna zygaena es una especie cosmopolita con hábitos semipelágicos y costeros (Casper et al., 2005). A nivel global, las investigaciones de su biología y ecología son pocas y limitadas. La talla de madurez en machos se ha estimado en 250 cm y para las hembras en 265 cm. Como sucede con el tiburón diamante, las hembras alcanzan mayores tamaños que los machos.
Siendo la tercera especie más desembarcada a nivel nacional, en la costa norte peruana, las hembras suelen presentar hábitos costeros durante estados de preñez y llegan a parir cerca a las costas, entre Tumbes y Lambayeque en los meses de diciembre y enero. Debido a ello, a estas zonas se les reconoce como área de crianza (González-Pestana, 2014). Esto también se observa en un análisis de desembarques de la pesquería artesanal durante el periodo 1996-2014. En este lapso, se evaluó la estructura poblacional de la especie frente a la costa peruana —se incluyó Tumbes, Piura, Lambayeque, La Libertad y Lima—, dando como resultado una mayoría de neonatos y juveniles. En diciembre y febrero de cada año se registró una alta presencia de neonatos; los juveniles solo se registraron en marzo y abril, y solo unos pocos individuos adultos pudieron ser registrados en diciembre (Imarpe, 2015).
Las especies de tiburones económicamente más importantes son el tiburón azul, tiburón diamante, tiburón martillo, tollo común, tiburón zorro común y angelote.
Shiga et al. (2016), en una evaluación de condición reproductiva, colectaron 31 individuos de tiburón martillo —10 hembras y 21 machos— con una longitud total entre 119 y 136 cm, en Tumbes y el norte de Piura, encontrando que todos eran juveniles. Por otro lado, el estudio de González-Pestana (2014) sobre ecología trófica del tiburón martillo en Perú indica que su alimentación cambia de acuerdo con la edad, pues juveniles y neonatos consumen especies costeras, mientras que los adultos consumen especies oceánicas.
Tollo común
Mustelus whitneyi es una especie endémica del Pacífico Sur, que se distribuye desde Ecuador hasta Chile. Es de hábitos bentónicos sobre la plataforma continental y se le encuentra entre los 16 y 211 m de profundidad, pero es más común entre los 70 y 100 m. Prefiere fondos rocosos alrededor de las islas y se alimenta de cangrejos, langostino mantis y pequeños peces óseos. Es un tiburón vivíparo y los machos alcanzan la madurez a los 68 cm, mientras que la talla de madurez en las hembras es de 74 a 87 cm (Romero, 2007). Sin embargo, la talla mínima legal de captura en el Perú es de 60 cm de longitud total.
Esta especie está categorizada por la UICN como Vulnerable porque se presume una disminución poblacional de más de 30 % después de un periodo de altas capturas en Perú (24 años entre 1966 y 1989). Actualmente, en territorio peruano se viene investigando la ecología trófica y biología reproductiva de esta especie, además de realizarse estudios morfológicos sobre los dentículos dérmicos (Kanagusuku et al., 2016).
Tiburón zorro común
Alopias vulpinus es una especie que habita en todos los mares: en aguas cálidas, templadas y frías (Compagno, 2001). Se le encuentra tanto en la zona oceánica como en la costera. Se estima que las hembras alcanzan la madurez sexual entre los 260 y 460 cm de longitud total, y los machos entre los 260 y 420 cm (Cailliet et al., 1983). Presenta reproducción vivípara con oofagia. Al igual que el caso del tiburón martillo, en esta especie las hembras preñadas se acercan a zonas costeras para parir, y las crías permanecen dentro de la zona costera hasta alcanzar la adultez (Moreno et al., 1989). En Perú, la información biológica disponible sobre esta especie solo proviene de los desembarques, los cuales ubican al tiburón zorro común en el quinto lugar a nivel nacional.
Angelote
Squatina californica es una especie bentónica que habita en sustratos arenosos en aguas templadas y tropicales. También se le encuentra alrededor de zonas rocosas y en profundidades entre 3 a 46 m (FAO-Figis, 2005). Se distribuye desde el sureste de Alaska hasta el Golfo de California y desde Costa Rica hasta el sur de Chile. Es una especie solitaria y seminómade con reproducción vivípara aplacentaria.
Históricamente, es la sexta especie de tiburones más capturada en Perú, y esta pesca ha impactado negativamente sobre su población, como lo reflejan las estadísticas de desembarque provenientes del Imarpe, que muestran una tendencia decreciente de captura cada año. A pesar de esta realidad, en el Perú se contaba con escasa información sobre su biología y ecología, la cual se limitaba a una descripción básica de su biología y distribución geográfica (Chirichigno y Cornejo, 2001). No obstante, recientemente se ha levantado información sobre su biología pesquera y comercialización, proveniente de la zona norte del Perú, lo cual aporta grandemente al conocimiento de esta especie (Maguiño et al., 2019b).
Además del S. californica, en el Perú también se encuentra el S. armata, especie muy parecida y conocida generalmente con el mismo nombre común. Su distribución está más concentrada en la zona sur, pero sobre la cual no se cuenta con datos de desembarques, siendo muy probable que dichos desembarques del S. armata estén siendo registrados conjuntamente con los del S. californica. Por otro lado, un estudio reciente que determinó la presencia del S. californica y S. armata también detectó, en el norte del país, una potencial tercera especie criptica no descrita (Cañedo-Apolaya et al., 2021).
Tiburón ballena
El tiburón ballena (Rhincodon typus) es una especie misteriosa que, si bien podría encontrarse a lo largo de la costa peruana, se agrega principalmente en las aguas norteñas de Tumbes y Piura. Maguiño et al. (2019a) evidenciaron que la agregación de tiburones está compuesta principalmente por machos juveniles, aunque también se pueden encontrar machos adultos, así como hembras juveniles y adultas. En esta zona de agregación, los individuos de tiburón ballena se encuentran principalmente entre primavera y verano, ausentándose el resto de los meses del año —sin saber aún a dónde van—, aunque esta estacionalidad está marcada por los factores ambientales y oceanográficos del mar (Gonzalez-Pestana et al. 2020). Asimismo, se sabe que tiburones marcados en Galápagos, Ecuador, se han trasladado hasta el borde de la plataforma continental, frente al norte del Perú, en un recorrido de 1 600 km (Hearn et al., 2016). Esta especie se encuentra protegida en el Perú desde el año 2017, por lo cual su pesca, transporte y comercialización son ilegales.
La pesquería de tiburones en el Perú
De las 66 especies de tiburones registradas en el Perú (Cornejo et al., 2015; Kelez et al., 2019), 31 son categorizadas como De interés comercial (Romero y Bustamante, 2007), las cuales sostienen pesquerías principalmente artesanales y de menor escala. Sin embargo, especies no categorizadas como De interés comercial también han sido desembarcadas, como el tiburón de profundidad (Somniosus pacificus) y el tiburón ballena (Rhincodon typus).
En la zona del Pacífico Sur, el Perú representaría el país con mayor volumen de desembarques de tiburones (FAO, 2020). Este dato es relativo, pues se revela un severo problema de inconsistencia en las estadísticas nacionales de desembarque de tiburones, para el periodo 1996-2018, de acuerdo al siguiente cuadro.
Es importante considerar que las estadísticas de desembarque del Instituto del Mar del Perú (Imarpe) son específicas por especie de tiburón, y representan muestras del desembarque nacional. En tanto, el Ministerio de la Producción (Produce) manejaría estadísticas del desembarque nacional total, aunque desagregadas solamente en dos grupos: Tollos, refiriéndose a las especies costeras y demersales, y Tiburones, refiriéndose a las especies pelágicas y oceánicas. Además, la verosimilitud de las estadísticas del Produce es cuestionable, dado que la metodología de muestreo del Imarpe es accesible, mientras que la metodología del mencionado ministerio no lo es.
De las 31 especies que son consideradas de importancia comercial (Romero y Bustamante, 2007), seis especies representan el 94 % del total de tiburones desembarcados entre 1996 y 2010, según Gonzalez-Pestana et al. (2016): tiburón azul (Prionace glauca), tiburón diamante (Isurus oxyrinchus), tiburón martillo (Sphyrna zygaena), tollo común (Mustelus whitneyi), tiburón zorro común (Alopias vulpinus) y angelote (Squatina californica).
Según el Primer Censo Nacional de la Pesca Artesanal en el Ámbito Marítimo del 2012 (I Cenpar), el recurso tollo aparece en la posición número 15 de la lista de las principales especies de peces objetivo de la pesca artesanal (INEI, 2012).
Flotas pesqueras artesanales y de menor escala
|
Las pesquerías artesanales y de menor escala están compuesta por embarcaciones con capacidad de bodega de hasta 32.6 m³ y hasta 15 m de largo. En el caso de las artesanales, tienen predominio de trabajo manual, mientras que las de menor escala tienen equipos y sistemas de pesca modernos. Según la Encuesta Estructural de la Pesquería Artesanal en el Litoral Peruano (Enepa), en sus ediciones I y II, y el Cenpar en su primera edición, el esfuerzo de la pesca artesanal ha aumentado considerablemente (Estrella, 2007; Produce, 2012; De la Puente et al., 2020). De esta manera, en los últimos 16 años, la cantidad de pescadores aumentó en 36.4 % y la de embarcaciones en 61.1 %, de acuerdo al cuadro que se presentará a continuación. En el estudio de De la Puente et al. (2020) se ha identificado que la flota pesquera artesanal es 5.4 veces mayor que en 1950. En el reporte se desprende que, entre el 2011 y 2018, cada año se construyeron, en promedio, 640 nuevas embarcaciones. También vale la pena resaltar que se ha dado un aumento sustancial en el uso de motor. Embarcaciones artesanales con este recurso pueden ir más lejos a pescar, aumentando sus posibilidades de capturar una mayor cantidad y diversidad de especies. En 1990, el 5 % de las embarcaciones tenía motor, situación que se revirtió para el 2018, donde la cifra subió a 91 %. |
Resultados de los Enepa I y II el I Cenpar
| Data | I Enepa | II Enepa | I Censo | Variación (%) |
| Fecha de realización | 1995-1996 | 2004-2005 | 2012 | 16 años |
| Puntos censados | 109 | 122 | 116 | |
| Pescadores | 28 082 | 37 727 | 44 161 | |
| Δ Pescadores | — | 34.30 % | 17.10 % | 57.30 % |
| Δ Pescadores anual | — | 3.80 % | 2.40 % | 3.60 % |
| Embarcaciones | 6 258 | 9 667 | 16 075 | |
| Δ Embarcaciones | — | 54.50 % | 66.30 % | 156.90 % |
| Δ Embarcaciones anual | — | 6.10 % | 9.50 % | 9.8 |
Fuente: Estrella, 2007; Produce, 2012
Para acceder a la pesca de tiburones no hay permisos de pesca específicos, solo se requiere tener un permiso de pesca artesanal, así como contar con los demás permisos regulares al día (carnet de tripulante, zarpe, etc.). Sin embargo, hay que cumplir con tallas mínimas de captura y porcentajes de tolerancia máxima de captura de ejemplares juveniles para un total de 13 especies de tiburones, tal y como se muestra en la siguiente tabla, según la Resolución Ministerial 209-2001-PEPuedes consultar la resolución completa dandole click aquí..
Tallas mínimas de captura (longitud total) y porcentajes de tolerancia máxima de captura de ejemplares juveniles
| Especie | Nombre común | Talla mínima de captura (cm) | Tolerancia máxima de juveniles |
|---|---|---|---|
| Carcharhinus spp. | Tiburón | 150 | 15 % |
| Carcharhinus altimus | Tiburón | 150 | 15 % |
| Carcharhinus brachyurus | Tiburón | 150 | 15 % |
| Carcharhinus falciformis | Tiburón | 150 | 15 % |
| Carcharhinus galapagensis | Tiburón | 150 | 15 % |
| Carcharhinus leucas | Tiburón | 150 | 15 % |
| Carcharhinus limbatus | Tiburón | 150 | 15 % |
| Carcharhinus longimanus | Tiburón | 150 | 15 % |
| Carcharhinus porosus | Tiburón | 150 | 15 % |
| Prionace glauca | Tiburón azul | 160 | 15 % |
| Isurus oxyrinchus | Tiburón diamante | 170 | 15 % |
| Mustelus mento | Tollo blanco | 60 | 20 % |
| Mustelus whitneyi | Tollo | 60 | 20 % |
| Triakis maculata | Tollo pintado | 60 | 20 % |
Fuente: Resolución Ministerial 209-2001-PE
:::::Conoce más sobre las tallas mínimas de captura, el consumo sostenible y las temporadas de veda de otras especies en: El tamaño sí importa: Una guía para el consumo responsable
Marco legal para el aprovechamiento del recurso tiburón
Si bien aún no se cuenta con algún reglamento de ordenamiento pesquero que regule la pesquería de tiburones en el Perú, en los últimos años se ha generado una serie de normas legales para el aprovechamiento adecuado de las diferentes especies de tiburones. Estas normas establecen lo siguiente:
- Tallas mínimas de captura y porcentaje de tolerancia máxima de captura de juveniles para 13 especies de tiburones. Sin embargo, algunas de las tallas establecidas presentan limitaciones. Primero, se asignó una misma talla mínima de captura para diferentes especies del mismo género. La Resolución Ministerial 209-2001-PE, indica que la talla mínima para tiburón (Carcharhinus spp.) es de 150 cm, sin considerar que este género incluye a ocho especies diferentes, para las cuales la madurez reproductiva depende de la especie. Segundo, las tallas mínimas establecidas para algunas especies están por debajo de la talla de mínima de reproducción. Este es el caso para el tollo común (M. whitneyi), el cual tiene una TMC de 60 cm, mientras que se ha encontrado que, en la región, la talla mínima de madurez sexual para machos es de 68 cm y para hembras está entre los 74 y 87 cm (Romero, 2007).
- Condiciones para el uso de artes y métodos de pesca. Por ejemplo, la longitud mínima de malla para las redes cortineras de tiburones está en el rango de 200 y 330 mm, según la Resolución Ministerial 209-2001-PE. Asimismo, el Decreto Supremo 021-2016-PRODUCEPuedes consultar el decreto completo dando click aquí. prohíbe la tenencia y empleo del arpón animalero.
- Prohibición de arrojar o descartar al mar ejemplares muertos o moribundos de tiburones capturados en los siguientes casos: para los tiburones mantequero (Carcharhinus falciformis), cazón (C. galapagensis), puntas negras (C. limbatus), puntas blancas (C. longimanus), azul (Prionace glauca), diamante (Isurus oxyrinchus), martillo (Sphyrna zygaena), gato (Heterodontus quoyi), zorro común (Alopias vulpinus), de aleta (Galeorhinus zyopterus) en la pesca del atún (RM 014-2001-PEPuedes consultar la resolución completa dando click aquí. y DS 032-2003-PRODUCEMediante este decreto se aprobó el Reglamento de Ordenamiento Pesquero del Atún. Puedes consultarlo completo dando click aquí.) y fume (Somniosus pacificus) en la pesca del bacalao de profundidad (RM 236-2001-PEMediante esta resolución de aprobó el Reglamento de Ordenamiento Pesquero del bacalao de profundidad. Puedes consultarla dando click aquí.).
- Límites máximos de captura incidental general (comprende osteíctios y condrictios), que son para el caso de la flota cerquera ≤ 5 % en peso del total de la captura por viaje; y para la flota espinelera ≤ 30 % en peso del total de la captura por viaje.
- Temporadas y cuotas de pesca anuales en el caso del tiburón martillo.
- 55 puntos autorizados de desembarque.
- Prohibición de extraer ciertas especies, como el tiburón ballena.
- Prohibición de desembarcar aletas de tiburones sueltas.
:::::Conoce más sobre las leyes que rigen en la pesquería peruana consultando la sección 2 de Reglas de Juego: El marco legal del sector pesca
Una de las más importantes normas que enmarcan la gestión pesquera y de conservación de tiburones es el Plan de Acción Nacional para la Conservación y Ordenamiento de Tiburones, Rayas y Especies Afines (PAN Tiburón-Perú). Este tiene los siguientes objetivos específicos:
- Desarrollar un sistema de información, seguimiento, monitoreo y evaluación de los tiburones, rayas y especies afines.
- Desarrollar un programa de investigación de las especies explotadas comercialmente, a fin de diseñar un plan de ordenamiento pesquero.
- Fortalecer el marco regulatorio, normativo y de control de las actividades pesqueras concordantes con los compromisos internacionales.
- Desarrollar programas de promoción, capacitación, difusión y sensibilización a entidades públicas y privadas, comunidades pesqueras y público general para la conservación y aprovechamiento sostenible de los tiburones, rayas y especies afines.
Dentro de estos objetivos, se dispone líneas de acción estratégica, actividades, proyectos, indicadores y metas que incluyen fechas límite de cumplimiento, de acuerdo a la Línea de Acción Estratégica 4 del documento del PAN Tiburón-Perú. Estas líneas de acción hacen referencia al sistema de recolección de información y base de datos; a la investigación científica y tecnología aplicada a la conservación; al marco normativo y de control, y a la promoción, capacitación, difusión y sensibilización. Asimismo, se establece las medidas de manejo, regulación pesquera, seguimiento y control. Y, por último, se determina que el Viceministerio de Pesquería será el ente encargado de hacer el seguimiento correspondiente al cumplimiento del Plan.
A continuación, se presentará una línea de tiempo con la normativa importante, tanto histórica como vigente, a nivel nacional y relacionada a la pesca y captura incidental de dichas especies:
Desembarques de tiburones
Seis especies representan el 94 % del total de tiburones desembarcados entre los años 1996 y 2010: tiburón azul (Prionace glauca), tiburón diamante (Isurus oxyrinchus), tiburón martillo (Sphyrna zygaena), tollo común (Mustelus whitneyi), tiburón zorro común (Alopias vulpinus) y angelote (Squatina californica), de acuerdo a Gonzalez-Pestana et al. (2016). Datos de los muestreos del ImarpeInformación que proviene del seguimiento de la pesquería artesanal del Imarpe, colectada por observadores de campo en forma diaria. Esta data corresponde a los desembarques por especie registrados en 35 puntos del litoral, considerados los más importantes debido a su volumen de desembarque (Produce, 2015). para estas seis especies de tiburones en el periodo 1996-2019 pueden observarse a continuación en el gráfico de desembarque de las seis principales especies.
En el gráfico se puede ver a primera vista que el tiburón azul es la principal especie desembarcada, superando ampliamente al desembarque de cualquier otra especie. Le siguen, en importancia, el tiburón diamante y el tiburón martillo. De estas tres especies, el azul y el diamante son tiburones oceánicos capturados casi exclusivamente con espinel. En tanto, al tiburón martillo se le puede capturar tanto con espinel como con redes de deriva, ya sea en zonas oceánicas o costeras, dado que es más cosmopolita (Imarpe, 2015).
Para el tollo común, el tiburón zorro común, el angelote y el resto de las especies, sus desembarques son menores. Sin embargo, mientras que los desembarques del tollo común no presentan una tendencia determinada (p = 0.72), el tiburón zorro común presenta una tendencia positiva significativa (p = 0.001), y el angelote presenta una tendencia negativa significativa (p = 0.001). El tollo común y el angelote son especies costeras, mientras que el tiburón zorro común es considerado una especie oceánica que se acerca a la costa solamente para reproducirse.
Del análisis de data de desembarques anuales nacionales en el lapso 1996-2018 (dos últimos cuadros), podemos observar lo siguiente:
- Incremento en los desembarques de tiburón azul y tiburón zorro común, así como disminución en los desembarques de angelote. En el caso del tiburón diamante, tollo común y tiburón martillo, no muestran alguna tendencia definida.
- Disminución en los desembarques de tiburón angelote, tendencia que, para este último, se agudiza desde el año 2001, según lo han informado Gonzalez-Pestana et al. (2016). Dichos investigadores reportan una disminución significativa en los desembarques de tiburón angelote a una tasa anual de 18.9 %, entre los años 2000 y 2010, preocupante tendencia que ha sido observada hasta el año 2016 y que continúa hasta el 2019.
Puntos de desembarques históricos y zonas de pesca de tiburones
Los tiburones son descargados en más de 97 puntos de desembarque a nivel nacional, según la data que colecta Produce, agrupada en tollos y tiburones, para el periodo 2000-2019. De ellos, los 25 más importantes en cuanto a desembarques se muestran en el siguiente gráfico. Sin embargo, desde el año 2016, se establecieron puntos de desembarques autorizados para tiburones.
De acuerdo al gráfico, el punto más importante es el puerto de Ilo (Moquegua), el cual recibió el 23 % del desembarque nacional total y se caracteriza por tener una flota importante de espinel que se dedica mayoritariamente a la pesca de tiburones antes que a la de tollos. Caso contrario es el de San José (Lambayeque), punto de desembarque donde llega el 14 % del desembarque nacional total de tiburones, en su mayoría representado por tollos (90 %).
Pucusana (Lima) ocupa el tercer lugar con un 8 % del desembarque total nacional y una mayoría de tiburones (69 %) debido a su flota de espinel. Salaverry (La Libertad), Callao (Lima) y Morro Sama (Tacna) representan un 6 %, 5 % y 4 % del desembarque nacional, respectivamente, y, junto con los anteriores puntos de desembarque, acumulan 60 % del desembarque total nacional de tiburones en el periodo 2000-2019.
Separando los desembarques por los grupos Tollo y Tiburón, las figuras cambian significativamente. Para los tollos, los dos puntos de desembarque más importantes están en la zona norte: San José (Lambayeque) con el 22 % y Parachique (Piura) con un 5 %. Le siguen puntos de desembarque como Coishco (Áncash), Pucusana (Lima), Végueta (Lima) y Paita (Piura), tal y como se presenta en el siguiente gráfico. Estos siete puntos suman el 51 % del desembarque total nacional para Tollo en el periodo 2000-2019.
Para la categoría Tiburones, de Produce, los puntos de desembarque más importantes están en la zona sur, siendo Ilo el punto más representativo, con el 42 %. En segundo y tercer lugar, se encuentran Pucusana y Callao, con el 11 y el 8 %, respectivamente. La zona norte aparece recién en el cuarto lugar de importancia, con un 7 % en Salaverry. En total, estos cuatro puntos de desembarque suman el 69 % de todos los desembarques para tiburón en el periodo 2000-2019. Los porcentajes y posiciones mencionados están consolidados en el gráfico a continuación:
Según la información de Produce-Transparencia (registrada en el lapso 2000-2019 y plasmada en el gráfico a continuación), para los 10 puntos más importantes de desembarque del grupo Tiburones, la zona sur, representada por Ilo, se ha mantenido como la principal aunque con ciertas variaciones en el tiempo. La zona centro, Pucusana y Callao ocupan un lugar secundario pero importante.
Puntos de desembarques y zonas de pesca de las especies más importantes
En cuanto a zonas de pesca específicas para diferentes especies de tiburones de importancia comercial, el Imarpe colecta esta información a través de sus observadores de campo. Esto lo hace en los puntos de desembarque donde realiza sus muestreos. Dicha información, lamentablemente, no es de fácil acceso público. Sin embargo, existen algunas publicaciones del Imarpe y otras entidades desde donde puede ser reconstruida. A continuación, se presentará información sobre desembarques y zonas de pesca de las especies más importantes:
• Tiburón azul y tiburón diamante
En los casos del tiburón azul y el tiburón diamante —ambas son especies oceánicas—, la información de las zonas de pesca se encuentra agrupada, dado que, como ambas son especies objetivo en la pesquería de espinel para tiburones, las fuentes de información no las separan (Elliot et al., 1995, 1996, 1997a, 1997b; Romero y Bustamante, 2007; Kelez et al., 2008; Doherty et al., 2014).
Como puede observarse en el siguiente mapa, las zonas de pesca de estas dos especies se encuentran, a lo largo de la costa peruana, fuera de la plataforma continental, con mayores áreas de pesca en la zona centro sur de Perú. Dichos espacios de pesca se extienden hasta Chile, incluyendo una considerable porción del norte de su Zona Económica Exclusiva (Doherty et al., 2014).
Zonas de pesca para el tiburón azul y el tiburón diamante
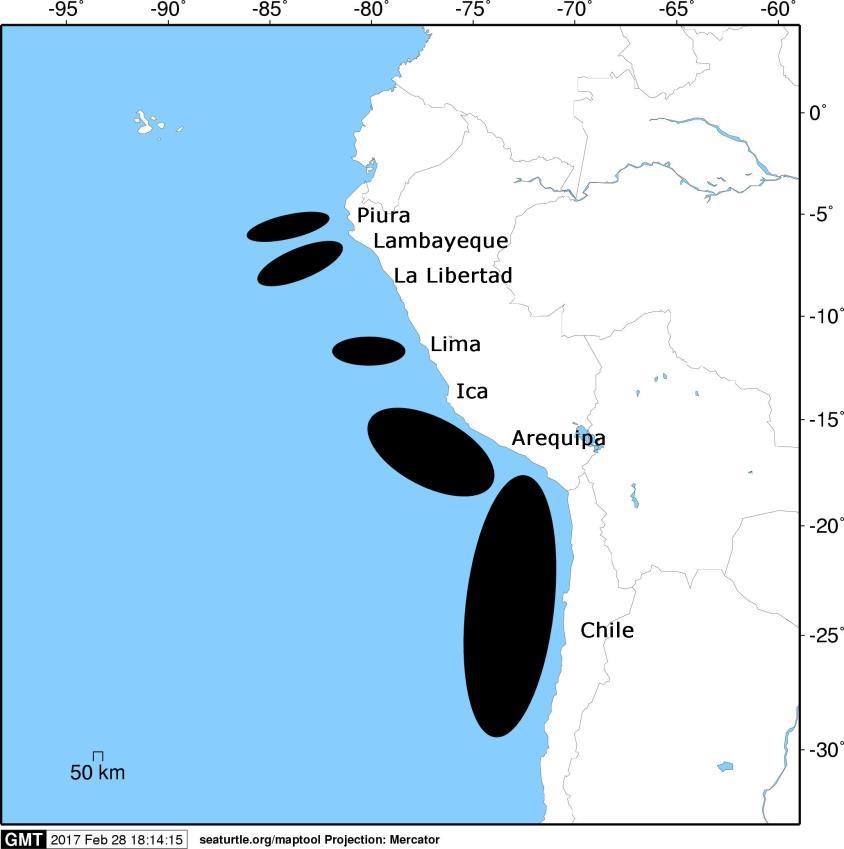
Fuente: Elliot et al., 1995, 1996, 1997a, 1997b; Romero y Bustamante, 2007; Kelez et al., 2008; Doherty et al., 2014
Información del Imarpe sobre los desembarques anuales de tiburón azul, por los ocho principales puntos de desembarque del año 2005 al 2019, muestra que el puerto de Ilo ha experimentado un aumento considerable en la cantidad de desembarques entre los años 2006 y 2016, según se observa en el grafico siguiente. No obstante, también se observan ligeras disminuciones recientes y un aumento actual en los desembarques en Salaverry. Dicho aumento también se ha observado en la frecuencia de desembarque en el puerto de Ilo, con relación a los demás puntos de desembarque, pasando de representar el 31 % del desembarque anual total en el 2005 a significar el 75 % en el 2015.
Pucusana (Lima) ocupa el tercer lugar con un 8 % del desembarque total nacional y una mayoría de tiburones (69 %) debido a su flota de espinel. Salaverry (La Libertad), Callao (Lima) y Morro Sama (Tacna) representan un 6 %, 5 % y 4 % del desembarque nacional, respectivamente.
Existen dos estudios que encontraron tendencias positivas en las Capturas por Unidad de Esfuerzo (CPUE) del tiburón azul en periodos entre el 2005 y el 2010 o 2014. En el primero, Adams et al. (2016) analizaron datos de desembarques para tiburón azul en Tacna, Moquegua y Arequipa, desde el año 2005 al 2014, encontrando CPUE en aumento después del año 2008. En el segundo estudio, Doherty et al. (2014) analizaron una muestra de viajes desde Ilo, en el periodo 2005-2010, encontrando CPUE para tiburones —70.6 % de ellas para tiburón azul y 28.4 % para tiburón diamante— con tendencias temporales positivas. Basados en estos dos estudios, podríamos asumir que la tendencia temporal positiva, en dichos periodos, en los desembarques del gráfico a continuación, responde a un incremento en la disponibilidad de tiburón azul en la zona sur.
En lo que respecta a variables ambientales, para la zona sur del Perú, Adams et al. (2016) encontraron una relación positiva entre la CPUE y las fases frías (Fenómeno de La Niña) del Índice El Niño Oscilación del Sur (ENSO) MultivariadoMultivariate ENSO Index (MEI), en inglés.. Asimismo, se encontró picos de CPUE en el rango de temperaturas superficiales del mar (TSM), entre 14.5 y 20° C, y CPUE más altas en los primeros 1 000 m de la columna de agua, así como también mayores CPUE en el suroeste y noroeste de su zona de estudio, tal y como se muestra en el siguiente gráfico.
Distribución espacial de CPUE para el tiburón azul
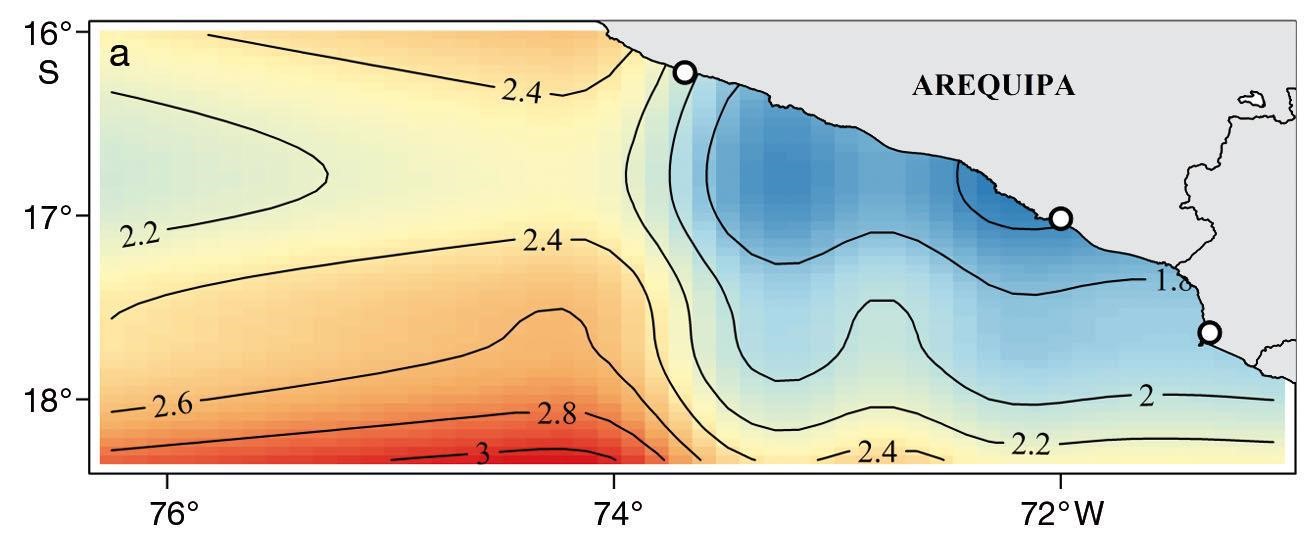
Fuente: Adams et al., 2016
Según data del Imarpe, para el periodo 2005-2019, el tiburón diamante —al igual que el tiburón azul— tiene como punto principal de desembarque al puerto de Ilo. Esta especie experimentó un aumento considerable en sus desembarques anuales, entre los años 2008 y 2011, al que le siguió una caída hasta 2013 y un posterior repunte hasta 2016. Luego, se muestra una nueva caída hasta el 2019, de acuerdo al gráfico que se presentará a continuación. En este punto de descarga, dicho comportamiento en los desembarques anuales es parecido al del tiburón azul.
Sobre el aporte al desembarque total nacional de tiburón diamante que Ilo representa, los valores han aumentado desde el año 2008, fluctuando entre 80 y 90 % en el periodo 2011-2015. Estos valores son muy altos y hasta superiores a los correspondientes al tiburón azul en Ilo. Dichos datos muestran que los desembarques de Ilo (zona sur) han cobrado más importancia en el tiempo, mientras que los desembarques de Pucusana (zona centro) han seguido una tendencia opuesta.
En el estudio de Adams et al. (2016), la CPUE disminuyó desde el 2005 hasta el 2010 para luego estabilizarse, siendo este un patrón distinto al reportado por Imarpe para la CPUE de este recurso. Por ello, con la información disponible en la zona sur y a partir de sus desembarques, no es posible inferir tendencias temporales en la disponibilidad de este recurso.
Adams et al. (2016) encontraron una relación inversa entre la CPUE de tiburón diamante con la concentración de clorofila, un pico de CPUE a los 20°C de TSM y CPUE más altas en los primeros 1 000 m de la columna de agua.
• Tiburón martillo
Las áreas de pesca del tiburón martillo, especie cosmopolita que habita tanto zonas oceánicas como neríticas, son principalmente costeras y se ubican en el sector norte del Perú, frente a las regiones Tumbes, Piura, Lambayeque y La Libertad. En estas zonas es donde las hembras grávidas vienen a reproducirse y la pesca artesanal captura neonatos, individuos juveniles y hembras adultas, según Castañeda (2001) y González (2014). Además de estas zonas principales, tal y como se muestra en el siguiente mapa, también hay áreas de pesca frente a Lima, de acuerdo a Elliot et al., 1996, 1997; Castañeda, 2001; Romero y Bustamante, 2007; González, 2014 e Imarpe, 2015.
Zonas de pesca para el tiburón martillo
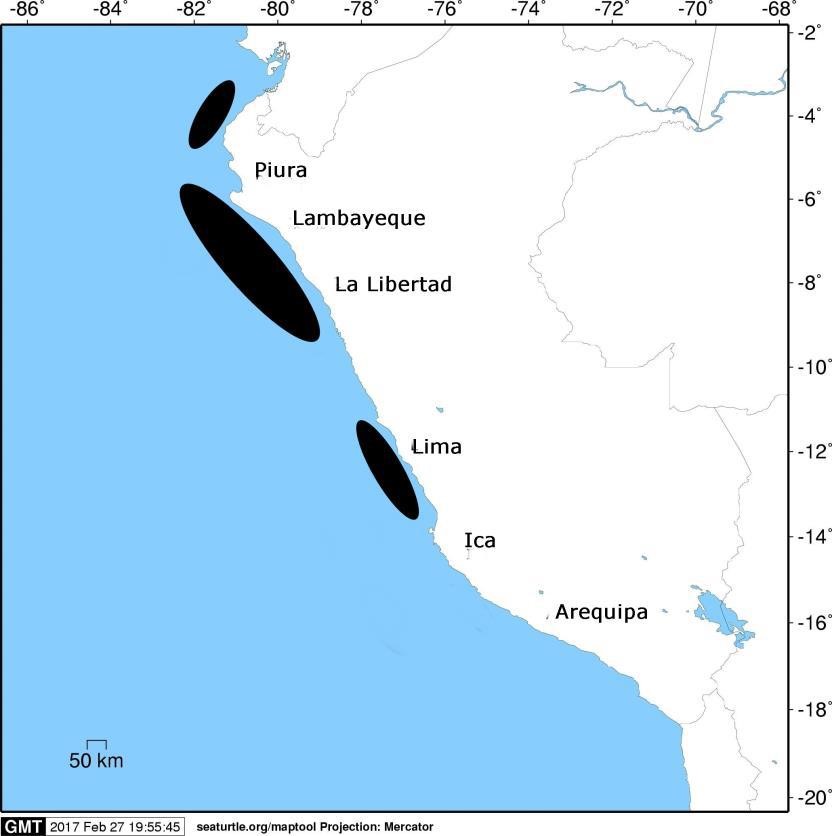
Fuente: Elliot et al. 1996, 1997; Castañeda, 2001; Romero y Bustamante, 2007; González, 2014 e Imarpe, 2015
En cuanto a la evolución de las descargas anuales de tiburón martillo por punto de desembarque, registrada por Imarpe en el periodo 2005-2019, se observa que hubo un cambio significativo en la importancia relativa de las zonas de desembarque. Esto se debió a que San José, punto que entre 2005 y 2009 se encontraba en condiciones similares a Salaverry, en los siguientes seis años sufrió una fuerte disminución en su aporte relativo al desembarque total anual —cayó de 30 % a 10 %, aproximadamente— y en sus términos de peso desembarcado, repuntando ligeramente en el 2016, tal y como se muestra en el siguiente gráfico. En los últimos años, Salaverry, a pesar de que también ha sufrido reducciones, es el punto más importante de desembarques, seguido de Máncora y San José.
- Tollo común
Para el caso del tollo común (Mustelus whitneyi), no se pudo obtener información de calidad sobre sus zonas de pesca. Hay un solo estudio de Romero y Bustamante (2007) que muestra una zona de pesca entre San Juan de Marcona y Atico. Sin embargo, según data del Imarpe, la mayor frecuencia de descargas de este recurso ocurre en puntos de desembarque de la costa norte, como San José (Lambayeque), Parachique, Puerto Rico y Paita (Piura). Las descargas en estos cuatro puntos de desembarque representan el 84 % del número total nacional de desembarques registrados para este recurso, en el periodo 2005-2019.
Según información del Imarpe, entre los años 2005 y 2019, mayormente, San José se ha mantenido como el punto de desembarque más importante para el tollo común, promediando con el 53 % del desembarque anual de este recurso. Además, en los últimos cuatro años del periodo analizado puede apreciarse una disminución en los puntos de desembarques, a excepción de San José, que sigue manteniendo altos valores de acuerdo al gráfico que se presentará a continuación.
• Tiburón zorro común
Algunos estudios muestran zonas de pesca para el tiburón zorro común (Alopias vulpinus) frente a Piura y Lambayeque (Elliot et al., 1996, 1997b), Lima (Elliot et al., 1997a) e Ica (Romero y Bustamante, 2007). La data de descargas del Imarpe por puntos de desembarque, que se presentará en el gráfico a continuación, indicaría también que las zonas más importantes están en la costa norte. Esto a causa de que Salaverry, Máncora y San José recibieron el 25 %, 18 % y 12 %, respectivamente, del número de desembarques acumulados en el periodo 2005-2019. Además, según el administrador del Desembarcadero Pesquero Artesanal (DPA) de Acapulco (Tumbes), existe una importante zona de pesca para este recurso en el Banco de Máncora (A. Mora, comunicación personal, 2017).
En lo que respecta a la evolución de las descargas anuales de tiburón zorro común por punto de desembarque, registrada por el Imarpe en el periodo 2005-2019, podemos observar que esta experimenta fuertes fluctuaciones en ciclos de tres a cuatro años. Además, presenta variaciones en la importancia relativa de dichos puntos de descarga. San José (2005-2007), Máncora (2008-2009, 2012, 2017) y Salaverry (2010-2016) se han alternado como los puntos de desembarque más importantes, tal y como se muestra en el siguiente gráfico. Sin embargo, en los últimos dos años, otros puntos de descarga, como Ancón y Chimbote, están teniendo mayores desembarques.
• Tiburón angelote
No existe literatura sobre las zonas de pesca del tiburón angelote (Squatina californica). Sin embargo, la información del Imarpe entre los años 2005 y 2019, muestra que los principales puntos de desembarque para esta especie estaban concentrados en el norte del Perú. Dichos puntos son Puerto Pizarro —acumula 67 % del desembarque nacional de angelote—, seguido de Puerto Rico (11 %), San José (9 %), Máncora (4 %) y Cancas (2 %), como se podrá apreciar en el siguiente mapa.
Mapa de los principales puntos de desembarque de angelote en el periodo 2005-2015
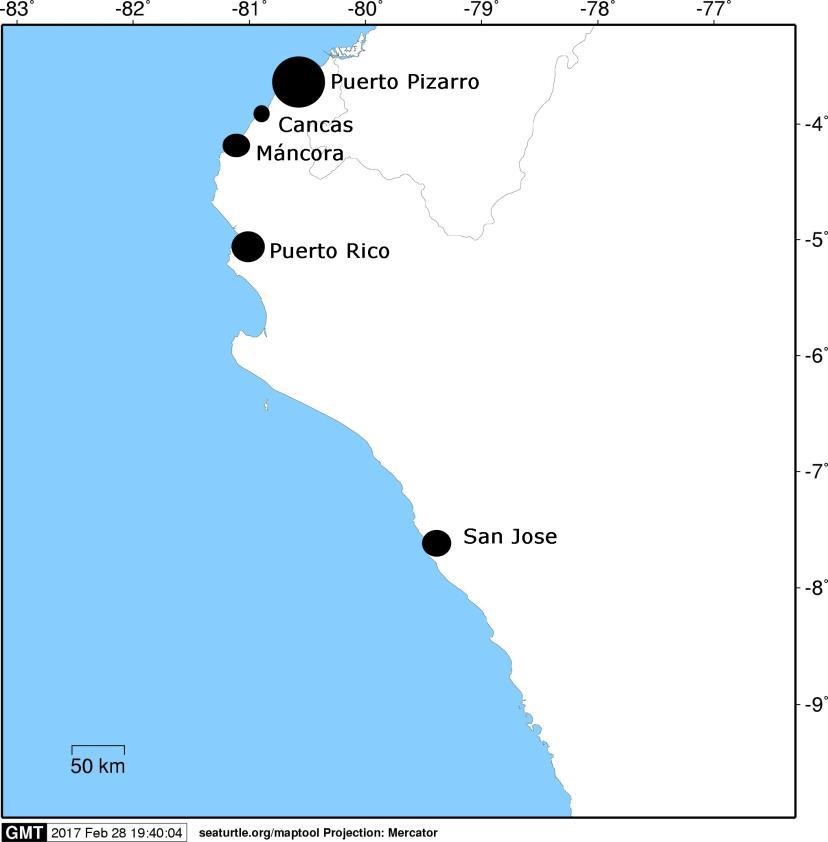
Fuente: Imarpe
En el periodo 2005-2019, Puerto Pizarro (Tumbes) se mantuvo como el sitio de desembarque de angelote más importante, con descargas anuales promedio en el 54 % del total desembarcado de esta especie. No obstante, en el año 2009 y en el periodo 2016-2018, la Caleta Puerto Rico tuvo el mayor desembarque. Desde del año 2010 en adelante, los desembarques de angelote en Puerto Pizarro han disminuido notablemente, repuntando ligeramente solo en el 2019. Estos datos se muestran en el siguiente gráfico.
Pesca de mayor escala de tiburones como «especies afines»
En la pesquería de mayor escala de atunes se utiliza tanto embarcaciones de cerco como de espinel. Las zonas de pesca de atunes son principalmente oceánicas y pelágicas, y, como muchas especies de tiburones y atunes comparten hábitats, la pesca de atunes tiene una significativa captura de tiburones.
La pesca de atún con redes de cerco puede ser desplegada con diferentes formas de lances, por ejemplo, sobre cardúmenes de atún, delfines o sobre Dispositivos Agregadores de PecesLos Dispositivo de Agregadores de Peces son una estructura o dispositivo permanente, semipermanente o temporal hecho de cualquier material y utilizado para atraer peces. (FAD, por sus siglas en inglés). En todos estos tipos de lance se apresa tiburones, siendo la frecuencia de captura considerablemente superior en los lances sobre los FAD, presumiblemente porque los tiburones buscan presas agregadas debajo de estos (Hall y Roman, 2013). En la pesquería de atún del Pacífico Este se ha observado una preocupante disminución en la frecuencia de captura de tiburones en los lances sobre los FAD (ibid.).
Como se mencionó al inicio, en el año 2001 se aprobó el primer ROP del atún, que consideraba 10 especies de tiburones como especies afines: tollo mantequero (Carcharhinus falciformis), cazón (C. galapagensis), tiburón puntas negras (C. limbatus), tiburón puntas blancas (C. longimanus), tiburón azul (Prionace glauca), tiburón diamante (Isurus oxyrinchus), tiburón martillo (Sphyrna zygaena), tiburón gato (Heterodontus quoyi), tiburón zorro común (Alopias vulpinus) y el tiburón de aleta (Galeorhinus galeus, sinónimo de G. zyopterus). Dicho ROP autorizaba la captura de estas 10 especies por parte de embarcaciones atuneras que emplean cerco o espinel. Por tanto, consideraba como captura incidental a cualquier otra especie de tiburón que resultase atrapada.
El mencionado ROP del Atún fue modificado y finalmente derogado por el Reglamento que entró en vigencia desde el año 2003. Sin embargo, las disposiciones referidas a los tiburones siguen siendo las mismas desde el 2001, al menos para los atuneros espineleros (Produce, 2003). Una medida de conservación importante que se ha mantenido es la prohibición de descartar los ejemplares de tiburones capturados, sean especies objetivo o no.
En ocasiones y con tasas significativas, la pesquería de atún con espinel captura incidentalmente algunas especies de tiburones. Por ejemplo, seis embarcaciones de bandera japonesa que operaron en aguas peruanas, entre noviembre de 1992 y octubre de 1993, tuvieron una captura incidental de tiburones que representó el 27 % de la captura total. Las especies capturadas fueron el tiburón azul (15.4 %), tiburón zorro común (7.5 %), tiburón diamante (3.7 %) y tiburón martillo (0.1 %), según Pellón y Cárdenas (2014). Lamentablemente, no se cuenta con estudios más recientes que detallen niveles actuales de captura incidental de tiburones en esta pesquería.
De todas las especies afines, las que más preocupan a nivel regional son, en primer lugar, el tollo mantequero y, en segundo, el tiburón puntas blancas. Estas dos especies han mostrado una gran disminución en sus capturas, así como en la CPUE en el Pacífico Este, según la información de la CIAT, de acuerdo a Hall y Roman (2013).
Uno de los grandes retos, no solo en la pesquería industrial de atún sino también en la de merluza y la pesquería de bacalao de profundidad, es que se cumpla con los reportes de las capturas de especies de tiburones y sus liberaciones o descartes. Otro reto importante es que las especies de tiburones que son capturadas incidentalmente en las pesquerías de cerco industrial, puedan ser liberadas vivas o, en su defecto, descartadas, dado que su consumo a bordo no debería darse. Las especies de tiburones que son capturadas con más frecuencia en esta pesquería son el tiburón martillo común, el tiburón azul y el tollo común (CeDePesca, 2018).
:::::La merluza es uno de los peces más importantes de la fauna marina. Para más información sobre este especie, ingresa aquí: Merluza (Merluccius gayi peruanus)
Artes y métodos de pesca usados en la pesquería de tiburones
Los artes de pesca utilizados para la captura de tiburones son las redes de cortina de deriva —cortinas pelágicas o animaleras— o de fondo, y el palangre o espinel de superficie (Alfaro-Shigueto et al., 2010). El espinel para tiburones es un arte de pesca utilizado en la zona oceánica en temporadas de pesca, que generalmente van de abril a noviembre (ibid.).
:::::Conoce más sobre las distintas técnicas de pesca en la serie ilustrativa elaborada por la Sociedad Peruana de Derecho Ambiental: Artes y métodos de pesca del Perú
El espinel es el arte de pesca que más tiburones captura en cuanto a toneladas métricas desembarcadas. Por ejemplo, desde el año 1996 hasta el 2000, rindió el 60 % en peso de toda la captura de tiburones correspondiente a dicho periodo, mientras que las redes capturaron solo un 32 % (Gonzalez-Pestana et al., 2016). Para el caso de los tiburones azul y diamante, el 79 % y 94 % del total de sus desembarques en peso fueron capturados con espinel, respectivamente.
Las redes, sin embargo, en general atrapan una mayor diversidad de tiburones, pues sus capturas comprenden unas 20 especies, entre pelágicas y bentónicas. Algunas de las especies que se capturan principalmente con redes son el tiburón martillo, tollo común, tiburón zorro común y angelote, en un 83 %, 85 %, 58 % y 86 %, respectivamente (Gonzalez-Pestana et al., 2016).
Las redes de deriva que se utilizan en ámbitos oceánicos, por ejemplo, para el tiburón martillo, se colocan en primavera y verano (Castañeda, 2001). En el caso de las redes de fondo, se colocan en zonas más costeras para especies como los tollos (Córdova et al., 2016). Existen otros artes de pesca que también capturan tiburones, aunque incidentalmente, como las redes de cerco y los chinchorros de playa (Gonzalez-Pestana et al., 2016). Cabe resaltar que los chinchorros de playa son artes de pesca prohibidos.
El espinel es el arte de pesca que más tiburones captura en cuanto a toneladas métricas desembarcadas.
Captura incidental de tiburones
Actividades de pesca, tanto pelágica como demersal que no tienen como especies objetivo a los tiburones, pueden resultar en su captura incidental cuando estos acompañan o comparten el mismo hábitat que el recurso objetivo. Actualmente, existen algunas iniciativas de mejoramiento tecnológico de los artes de pesca dirigidas a reducir la captura incidental. Sin embargo, estas iniciativas son escasas y están dirigidas a muy pocas especies.
En el Perú, las especies de tiburones capturadas de manera incidental son, en la mayoría de casos, aprovechadas por los pescadores. El cuadro que se presentará a continuación incluye una relación de actividades nacionales de pesca marítima, en las cuales existe captura incidental de tiburones.
Actividades nacionales de pesca marítima que capturan incidentalmente tiburones
| Clasificación | Arte de pesca | Especie objetivo | Especies incidentales | Comentarios |
|---|---|---|---|---|
| Mayor escala | Red de cerco | Atunes |
|
En el 2015, se modificó el ROP del atún para excluir de su lista de especies objetivo a las «especies afines». Esto implica que todo condrictio capturado por alguna embarcación atunera cerquera tendría que ser considerado como captura incidental. Esta última, en general, debe ser ≤5 % de la captura total de la embarcación por viaje de pesca (Hall y Roman, 2013, y Produce, 2003). |
| Mayor escala | Red de cerco | Bonito |
|
Durante un estudio de pesca exploratoria para el bonito, entre enero y marzo del 2016 en aguas costeras frente al litoral de Ica, se pescaron de manera incidental individuos de tiburón martillo. Esto representó el 17 % de la captura incidental (Produce, 2014 y Román et al., 2016). |
| Mayor escala | Red de cerco | Anchoveta |
|
Especies capturadas incidentalmente (CeDePesca, 2018). |
| Mayor escala | Espinel | Atunes |
|
|
| Mayor escala | Red de arrastre | Merluza |
|
Estudios mediante observaciones a bordo en esta pesquería muestran que la tasa de captura de tiburones es considerable (Céspedes Madalengoitia, 2014). |
| Artesanal | Líneas de mano | Varias especies |
|
|
| Artesanal | Espinel | Perico |
Los tiburones azules capturados están por encima de la talla mínima legal, mientras que el diamante está por debajo de la talla mínima. |
– Tiene un gran esfuerzo pesquero, que se estima en más de 80 millones de anzuelos lanzados al año (Alfaro-Shigueto et al., 2010). Tiene una temporada de pesca y una veda anual, además cuenta con un ROP y medidas complementarias que están siendo elaboradas. Generalmente, estos tiburones son retenidos, pero disposiciones complementarias al ROP deberían regular la captura incidental y su reporte.
– Los tiburones azules capturados están por encima de la talla mínima legal, mientras que el diamante está por debajo de dicha talla. |
| Artesanal | Redes de cerco | Especies pelágicas |
|
:::::Conoce más sobre la captura incidental y los artes y métodos que se usan en ella para esta y otras especies consultando la sección 7 de Reglas de Juego en el Sector Pesca: Captura incidental
Retos relacionados a la pesquería de tiburones
El problema de la sustitución de especies en tiburones
La sustitución de especies representa un problema grave para la conservación de los recursos pesqueros a nivel internacional. En perjuicio de los consumidores, este escenario induce a incurrir tanto en un inadecuado manejo por parte de los responsables de decisiones como en la ocurrencia de ventas mal informadas y fraudes. La sustitución de especies, es decir, vender una especie bajo el nombre de otra especie, sucede por las siguientes razones:
• Vacíos de información
• Incentivos económicos perversos
• Falta de trazabilidad y de nombres oficiales para especies de valor comercial
• Débil conciencia ciudadana y responsabilidad como consumidor
• Débil fiscalización pesquera. En el Perú, se ha identificado que una misma especie de pez puede llegar a ser capturada, desembarcada y comercializada, con hasta cuatro o cinco nombres distintos (Oceana, 2018). De la misma manera, muchas especies pueden estar comercializadas bajo un mismo nombre.
Este problema afecta seriamente a los tiburones, ya que, por ejemplo, el término «tollo» es utilizado como un nombre genérico para ciertas especies de tiburones de dientes pequeños de las familias Carcharhinidae, Scyliorhinidae, Squalidae y Triakidae (Biffi et al., 2020). Estas, por su carne blanca, eran bastante apreciadas para diversas preparaciones culinarias.
Sin embargo, a medida que los desembarques del tollo fueron disminuyendo y el recurso escaseó, se empezó a utilizar su denominación para vender otro tipo de tiburones. Esto se ve, por ejemplo, en nombres como tollo diamante o tollo azul (Marín et al., 2018; Biffi et al., 2020). Según el estudio de Oceana (2018), los casos más comunes de sustitución por tollo son tiburón azul, tiburón diamante, tiburón martillo y tiburón zorro.
Uno de los problemas más críticos derivados por el uso del nombre genérico “tollo” es que muchos de los consumidores peruanos no saben que el tollo es una especie de tiburón. Asimismo, desconocen que todas las especies vendidas bajo dicho nombre representan varias especies de tiburones. Esto no solo impide el consumo consciente, sino también representa una estafa a los consumidores que pagan por algo que no es. De igual manera, al no tener claro lo que se está comercializando, esto tampoco permite el manejo sostenible de los tiburones, ya que no se sabe qué especies ni cuánto es lo que se está vendiendo en los mercados y restaurantes.
Finalmente, el consumo no consciente de tiburones es también un problema de salud pública. Estos peces, al ser los depredadores topes, es decir, al estar situados en lo alto de la cadena alimenticia, tienden a tener altas concentraciones de metilmercurio (MeHg). Este elemento es muy tóxico, el cual afecta de manera importante tanto al sistema nervioso central como a la capacidad pulmonar. Esto es particularmente problemático para mujeres embarazadas, ya que los efectos nocivos del mercurio pueden ser transmitidos de la madre al feto, afectando su correcto desarrollo.
El mercurio tiende a bioacumularse en los tejidos de cada organismo vivo que lo consume, y, cuando este organismo es consumido por un predador, este por otro predador, y así sucesivamente, la concentración de mercurio en los organismos va aumentando conforme se asciende a lo largo de la cadena alimenticia. A esta consecución se le conoce como biomagnificación (Kehrig et al., 2017). Por ello, los depredadores topes como los tiburones tienden a tener una mayor bioacumulación de mercurio en su carne, en comparación con otros organismos marinos (Gonzáles-Pestana et al., 2017).
Según el estudio de Oceana (2018), los casos más comunes de sustitución por tollo son tiburón azul, tiburón diamante, tiburón martillo y tiburón zorro.
Un estudio reciente de Perú encontró una concentración promedio de MeHg de 407 ng/g peso húmedo (rango 21.4-2 534.0 ng/g), para 77 muestras de tiburones, representando ocho especies (Biffi et al., 2020). Como referencia, la Agencia de Protección Ambiental (EPA, por sus siglas en inglés) de los Estados Unidos recomienda no consumir especies con niveles de mercurio por encima de los 300 ng/g (Biffi et al., 2020). Otro estudio, enfocado en tiburón martillo, halló que, en promedio, esta especie tenía 390 ng/g ph (Gonzáles-Pestana et al., 2017).
Contenido de mercurio (ng/g peso húmedo) promedio por especie
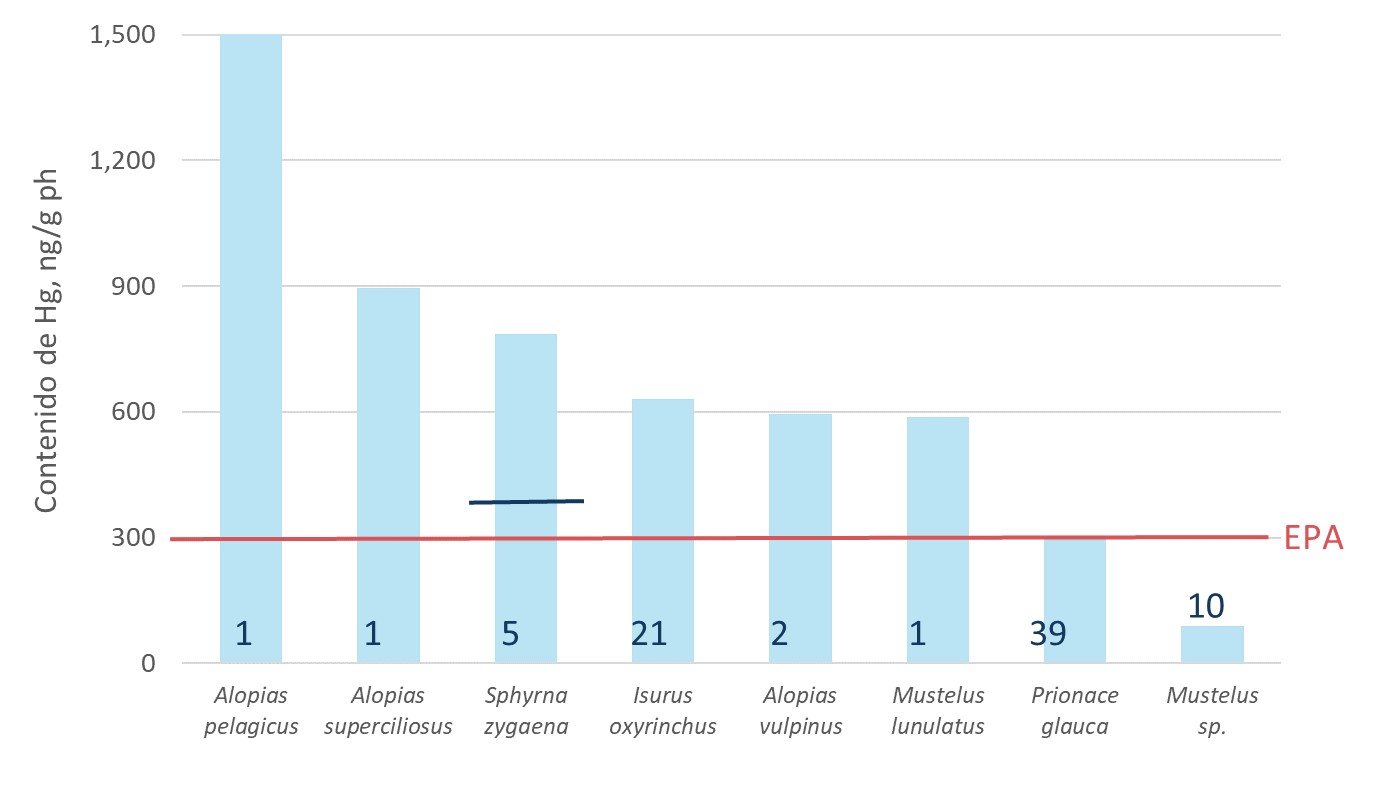
La línea roja indica el valor máximo propuesto por la Agencia de Protección Ambiental de EE.UU. (EPA). La azul indica el valor promedio de mercurio (ng/g ph) determinado por González-Pestana y colaboradores (2017). El número de cada barra indica la cantidad de muestras analizadas.
Fuente: Biffi et al. (2020) y González-Pestana et al. (2017)
Dos recursos clave para la identificación de tiburones una vez capturados son la Guía de Campo para la Determinación de Tiburones en la Pesca Artesanal del Perú del ImarpePuedes revisar el documento completo dando click aquí. (2015) y la Guía de Identificación de Aletas de Tiburones en el Perú de Oceana PerúPuedes revisar el documento completo dando click aquí. (2018).
Percepciones negativas hacia los tiburones
A nivel internacional, los medios han reforzado estereotipos negativos hacia los tiburones, dándoles el perfil de comehombres (Muter et al., 2012). El ejemplo más claro de esto es la película ‘Tiburón’ —‘Jaws’, en inglés—, de 1975, la cual presentó a estos peces como sangrientos asesinos. La mala fama por diferentes medios de comunicación hacia los tiburones también se da en Perú, donde comparten, con frecuencia, noticias acerca de ataques de tiburones hacia personas en otros países. Esto sucede pese a que, según la plataforma Shark Attack DataPara consultar la web de Shark Attack Data, dale click aquí., en el Perú jamás se ha registrado un ataque de tiburón.
El problema del poco conocimiento y las actitudes negativas hacia los tiburones por parte de la ciudadanía, es que limita su interés y participación por la conservación de estas increíbles especies (Garla et al., 2015). Si bien se ha visto un cambio de actitudes a nivel mundial, como el de protegerse de los tiburones a querer protegerlos (Simpfendorfer y Dulvy, 2017), surge la pregunta si este mismo cambio se está dando en Perú. Esta transición de actitudes negativas a positivas es clave para lograr el buen manejo de los tiburones (Friedrich et al., 2014).
El consumo no consciente de tiburones es también un problema de salud pública. Estos peces, al ser depredadores tope, tienden a tener altas concentraciones de metilmercurio, un elemento muy tóxico que afecta considerablemente tanto al sistema nervioso central como a la capacidad pulmonar.
En el 2018, se publicó un estudio que evaluó los conocimientos, actitudes y patrones de consumo de las y los peruanos costeros en relación a los tiburones (López de la Lama et al., 2018). Para ello, se diseñó e implementó una encuesta en las 10 ciudades costeras principales del país, reclutando 2 004 participantes. Del total, el 56 % fueron hombres y 44 % mujeres, con una edad promedio de 40 años (± 14 años), y el 67 % contaba con estudios superiores (universidad o instituto técnico). A continuación, mostraremos los resultados principales, organizados en patrones de consumo, conocimientos y actitudes.
Patrones de consumo
Los resultados principales arrojaron que el 72 % de los participantes consumen tiburón, es decir, 7 de cada 10 participantes. Las ciudades norteñas fueron las de mayor consumo de tiburón, donde destacan Tumbes, Piura, Chiclayo y Trujillo. En las tres primeras ciudades, más del 90 % de los participantes afirmaron consumir tiburón. En Chiclayo, el tollo fue el segundo pescado favorito. A nivel nacional, el tollo fue el cuarto pescado favorito. En el siguiente cuadro, se presentará la relación entre consumo de tiburones (porcentaje de respuestas positivas respecto de la muestra de encuestados por región) y las latitudes de las ciudades.
Relación entre consumo de tiburones y latitudes de las ciudades
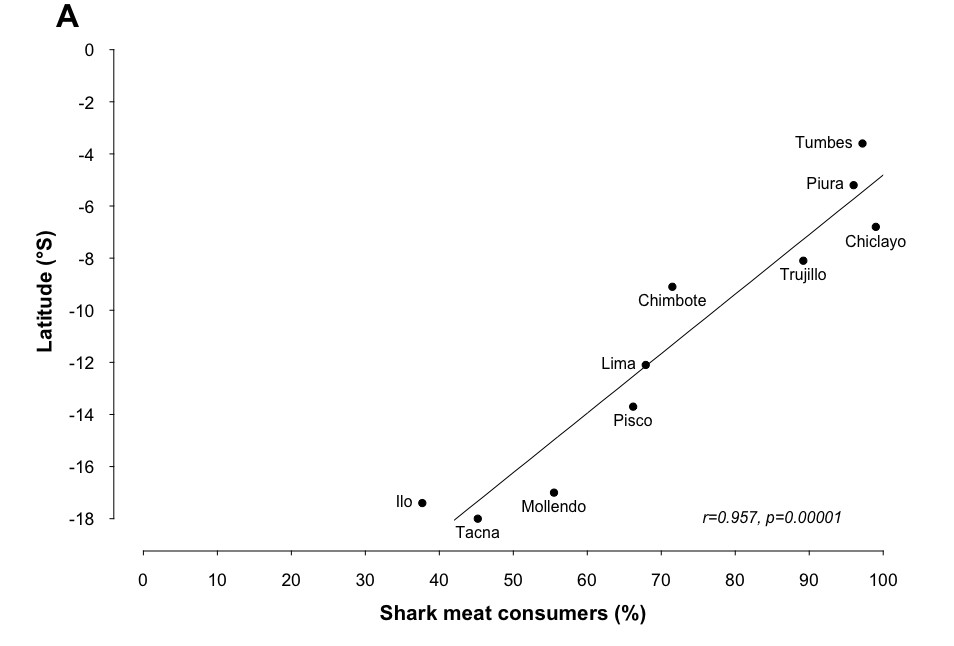
Fuente: López de la Lama et al. (2018)
En cuanto a patrones de consumo de tiburón, solo 6 de 10 personas eran consumidores actuales de tiburón. De estos, el 37.6 % consumía tollo una vez al mes, 32.7 % eran consumidores regulares —por lo menos dos veces al mes— y un 29.6 % consumía tiburón de manera infrecuente. Es así que, si bien la percepción del consumo de carne de tiburón era común, la práctica del consumo no era frecuente.
Conocimiento acerca de tiburones
Uno de los principales problemas en cuanto al conocimiento de los tiburones, es la confusión que se tiene con la denominación «tollo». En la actualidad, dicho término es utilizado como nombre genérico para casi cualquier especie de tiburón. Es así que, si bien el 72 % de los participantes afirmó consumir tollo, solamente el 17 % declaró saber que este era un tipo de tiburón. Por ende, por cada 10 participantes, 7 se declaraban consumidoras de tollo. No obstante, de esas 7, solo 2 eran conscientes de que este era un tipo de tiburón.
Ilo es la ciudad más consciente del consumo de tiburón, es decir, las personas saben que el tollo es un tipo de tiburón. Esta localidad es interesante porque, si bien es una de las ciudades con menor consumo de tiburón —alrededor del 35 % de sus participantes afirmaron consumir tiburón—, más del 60 % de sus encuestados sabe que el tollo es tiburón. Esto podría explicarse gracias a su importancia como punto de desembarque para tiburones. En el caso de Piura, una de las ciudades con mayor consumo —96 % de los participantes—, hay una menor conciencia de que el tollo es una especie de tiburón (17 %).
En cuanto a conocimiento, el 58 % de los participantes mencionó que sí hay tiburones en el Perú. En Tumbes es donde más personas saben que hay tiburones en el país (82.6 %), mientras que en Tacna y Pisco es donde más personas dijeron que no hay (30.3 % y 29.9 %, respectivamente). También se identificó que, mientras más jóvenes fuesen los participantes, menor conocimiento tenían acerca de tiburones. Esto podría ser un indicador de que las nuevas generaciones conocen menos de los ecosistemas marinos y sus recursos naturales.
Entre las personas que sabían de la existencia de tiburones en el Perú, solo el 34 % logró mencionar un nombre común específico. En sí, el tiburón más mencionado por los participantes fue el tiburón azul (27.3 %), seguido por el tollo (18.1 %), tiburón martillo (16.8 %), tiburón blanco (14.9 %) y tiburón diamante (14.5 %). En total, entre todos los participantes, se mencionaron solamente 9 de las 67 diferentes especies de tiburones que existen en el país.
Actitudes hacia los tiburones
A fin de evaluar las actitudes de los participantes hacia los tiburones, se les pidió que mencionaran tres palabras que pudieran rápidamente asociar con el término «tiburón». Se registraron 354 palabras diferentes, con un total de 5 772 repeticiones. De todas estas palabras, hay 10 principales que agrupan el 58 % del total. Los 10 términos más populares fueron: miedo, peligroso, grande, sangre, muerte, dientes, mar, depredador, asesino y peligro. Como se puede ver, en general, algunas de esas palabras reflejan actitudes negativas hacia los tiburones.
Ilo es la ciudad más consciente del consumo de tiburón, es decir, las personas saben que el tollo es un tipo de tiburón.
Estas palabras se agruparon en tres categorías: positivas, negativas y neutras. En resumen, el 55 % de las palabras obtenidas fueron negativas; el 32 %, neutras, y el 13 % fueron positivas. Las neutras incluyen palabras asociadas al conocimiento de estos peces —por ejemplo, si son grandes, si viven en el mar o si tienen dientes— así como otras no necesariamente asociadas de manera directa con los tiburones o misceláneas —por ejemplo, “azul” o “película”—, tal y como se muestra en el siguiente cuadro.
Categorías y subcategorías de las palabras mencionadas por los participantes de una encuesta de percepción acerca de los tiburones
| Categorías | Subcategoría | Palabras más comunes |
|---|---|---|
| Palabras positivas (13 %) | Beneficios (10 %) | Aletas, comidas, cartílago |
| Rasgos positivos (2 %) | Fuerte, rápido, grande | |
| Sentimientos positivos (1 %) | Asombro, genial, respeto | |
| Palabras negativas (55 %) | Interacciones negativas con humanos (14 %) | Sangre, muerte, ataque |
| Rasgos negativos (19 %) | Peligroso, asesino, feroz | |
| Sentimientos negativos (22 %) | Miedo, terror, pánico | |
| Palabras neutras (32 %) | Conocimiento de biología y ecología (26 %) | Grande, dientes, mar |
| Miscelánea (6 %) | Película, playa, azul |
Fuente: López de la Lama et al., 2018
En base a estos resultados se puede afirmar que, pese a la contribución clave de los tiburones a la sociedad —en términos de alimento, empleo, rol ecológico, atractivo turístico y potencial biotecnológico—, las actitudes negativas hacia ellos son muy dominantes a lo largo de la costa peruana. Esto nos lleva a reflexionar en la necesidad de generar mayores espacios de reconexión con el mar y los tiburones, como parte de una estrategia que fomente un cambio de actitudes hacia ellos por parte de la ciudadanía. De esta manera, se reforzaría la correcta protección y el efectivo ordenamiento pesquero de este importantísimo grupo de peces.
Comercio internacional y el denominado aleteo de tiburones
Importaciones
Según los datos disponibles en la Superintendencia Nacional de Aduanas y Administración Tributaria (Sunat), el Perú viene importando productos de tiburón —aletas y carne— desde 1998. El total importado desde el año mencionado hasta el 2018 es de 32 067 toneladas métricas (TM). El 96 % de estas importaciones corresponden a los productos cárnicos y el 4 % a las aletas. En el caso de la carne, las importaciones vienen principalmente desde Ecuador, con un 54 % del total; le sigue, en importancia, un 18 % que proviene de aguas internacionales, tal y como se muestra en el siguiente gráfico.
En lo que respecta a las aletas, el 74 % de nuestras importaciones proviene de Ecuador, seguido del 24 % que viene de aguas internacionales, según muestra el cuadro a continuación:
Exportaciones
En el caso de las exportaciones, se dispone de datos desde el año 1997. La cantidad total exportada de productos de tiburón —aletas y carne— asciende a 14 279 TM. Los principales destinos a los cuales exportamos tiburón son Brasil y Hong Kong, con un 51 % y 20 % de los productos en general, respectivamente.
El 75.5 % del total exportado corresponde a la carne, mientras que las aletas conforman el 24.5 % restante de la exportación. Hong Kong es nuestro principal destino de exportación de aletas de tiburón, pues en los últimos 20 años le hemos vendido el 85 % de la producción total de dicho periodo, lo que representa 2 954 (TM). Los siguientes destinos más importantes para exportación de aletas son Singapur, con el 6 % del total exportado (224 TM) y Japón con el 1 % (189 TM). Perú ocupa el puesto 11 en exportación de aletas a Hong Kong, según el mapa de exportaciones direccionadas a dicha región que se muestra a continuación.
Exportaciones del 2011 de aleta de tiburón a Hong Kong
Fuente: PEW, 2012
En el cuadro que se presentará a continuación, se observa que, desde el año 1997 hasta el 2002, Perú era principalmente exportador de productos de tiburón. Sin embargo, a partir del 2003 hasta la actualidad, las importaciones sobrepasaron a las exportaciones. A lo largo del tiempo, estas importaciones han crecido en cantidad y mantienen una tendencia positiva. En lo que respecta a la carne, a partir del 2003 comenzamos a importar mayores cantidades en comparación a los montos que exportamos.
Exportaciones e importaciones anuales de tiburón (carne y aletas)
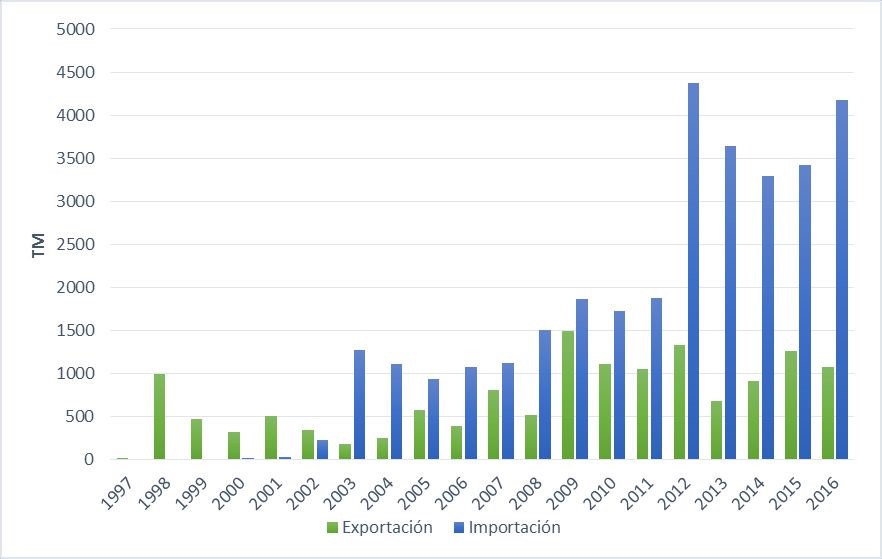
Fuente: Sunat
Para el caso de aletas, la información obtenida muestra que, todos los años, las cifras de exportación superan a las de importación. Sin embargo, en los últimos años, estamos importando cantidades más altas de aletas que provienen principalmente del Ecuador, tal y como se plasma en el cuadro a continuación. Esto podría convertir al Perú en un punto de acopio de aletas para reexportar a Asia.
Exportaciones e importaciones anuales de aletas de tiburón

Fuente: Sunat
En lo referente al comercio internacional de condrictios, 17 especies de elasmobranquios presentes en aguas peruanas están incluidas en el Apéndice 2 del acuerdo que regula la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (Cites), del cual el Perú es parte. Esto implica que su comercio internacional se permite, pero también se controla.
Las especies en cuestión son las siguientes: tiburón oceánico punta blanca (Carcharhinus longimanus), tollo mantequero o tiburón sedoso (C. falciformis), tiburón martillo festonado (Sphyrna lewini), gran tiburón martillo (S. mokarran), tiburón martillo liso (S. zygaena), tiburón peregrino (Cetorhinus maximus), gran tiburón blanco (Carcharodon carcharias), tiburón marrajo (Lamna nasus), tiburón ballena (Rhincodon typus), tiburón zorro (Alopias vulpinus), tiburón zorro pelágico (A. pelagicus), tiburón zorro ojón (A. superciliosus), y mantas diablo (Mobula japanica, M. munkiana, M. thurstoni y M. tarapacana).
Nota de los autores sobre los datos usados en este documento
La información usada en este documento proviene de tres fuentes principales: Ministerio de la Producción (Produce), Instituto del Mar del Perú (Imarpe) y autoridades regionales de producción y empresas, las mismas que presentan inconsistencias entre sí. La información del Imarpe es colectada directamente por sus observadores de campo en los 35 principales puntos de desembarque, por lo que solo representa un muestreo de los desembarques, mas no la totalidad. Al Imarpe se le solicitó la información de desembarques anuales, mensuales y por punto de desembarque para todas las especies comerciales de tiburones, enmarcada en el periodo 1996-2016. Sin embargo, solo se recibió información anual y por punto de desembarque para 16 especies, entre los años 2000 y 2015. Con ello se complementó información para otras especies y periodos, previamente solicitada por otros investigadores a quienes Imarpe sí les proporcionó dichos datos. La información alcanzada por Produce viene de dos envíos. El primero fue solicitado por vía regular a través de la Ley de transparencia y acceso a la información pública. Se solicitó información de desembarques anuales, mensuales y por punto de desembarque para todas las especies de tiburones desde el año 1986 hasta el 2016. Se recibió desembarques anuales y mensuales por punto de desembarque desde el 2010 hasta el 2015, pero no por especie, sino agrupado en tollos y tiburones. Los puntos de desembarque incluidos fueron 94 en total. La fuente de información es citada como empresas pesqueras y Direcciones Regionales de la Producción (Direpro). Esta data es citada en el presente documento como Produce-Transparencia. El segundo envío fue solicitado por correo electrónico, cuando buscábamos obtener data más antigua. Dicha remisión incluyó información de desembarques anuales para tiburón desde el año 1980 hasta el 2015, y para tollos desde 1991. En el documento enviado se observa que la información proviene de los anuarios estadísticos. Esta data es citada en el presente documento como Produce-Anuarios Las diferencias entre ambos envíos de Produce son considerables, y desconocemos las razones de la gran disparidad. Consideramos que la información del primer envío es más confiable. Cabe mencionar que el presente contenido corresponde a la primera publicación hecha en Wikipesca.
Cita sugerida
| Kelez, S.; Mendoza, A.; Maguiño, R.; Riveros, J. y López, R. (2022). Tiburones. En: Sociedad Peruana de Derecho Ambiental, Wikipesca Perú. Plataforma colaborativa sobre la pesca en el Perú. Recuperado de: https://mardelperu.pe/articulos_wikipesca/tiburones |
Redacción de la sección: Shaleyla Kelez, Alejandra Mendoza, Rossana Maguiño, Juan Carlos Riveros y Rocío López
Consejo editorial para esta sección: Ricardo Bandín y Bruno Monteferri
Edición de textos: Ricardo Muñoz
Cita general: Sociedad Peruana de Derecho Ambiental – SPDA (2019). Wikipesca Perú. Plataforma colaborativa sobre la pesca en el Perú. Recuperado de https://www.alamar.pe/mardelperu/
Referencias bibliográficas
- Adams, G.; Flores, D.; Galindo, O.; Aarestrup, K. y Svendsen, J. (2016). Spatial ecology of blue shark and shortfin mako in southern Peru: local abundance, habitat preferences and implications for conservation. Endangered Species Research, 31: 19-32. Disponible en: doi: 10.3354/esr00744
- Alfaro-Shigueto, J.; Mangel, J.; Pajuelo, M.; Dutton, P.; Seminoff, J. y Godley, B. (2010). Where small can have a large impact: structure and characterization of small-scale fisheries in Peru. Fisheries Research, 106: 8-17.
- Altamirano-Sierra, A. y Vargas-Nalvarte, P. (2014). The White Shark (Carcharodon carcharias) in the Ancient Peruvian Ceremonial Centre of Huaca Pucllana. International Journal of Osteoarchaeology. Int. J. Osteoarchaeol. (2014) Published online in Wiley Online Library. Disponible en: https://doi.org/10.1002/oa.2401
- Baum, J.; Myers, R.; Kehler, D.; Worm, B.; Harley, S. y Doherty, P. (2003). Collapse and conservation of shark populations in the Northwest Atlantic. Science, 299: 389-392.
- Baum, J. y Myers, R. (2004). Shifting baselines and the decline of pelagic sharks in the Gulf of Mexico. Ecology Letters, 7: 135-145.
- Biffi, D.; López-Mobilia, A.; Kelez, S.; Williams, D.; Chumchal, M. y Weinburgh, M. (2020). Mislabelling and high mercury content hampers the efforts of market-based seafood initiatives in Peru. Scientific Reports, 10, 1-12. Disponible en: https://doi.org/fztp
- Briones-Mendoza, J.; Pincay-Espinoza, J.; Palma-Chávez, J. y Romero-Caicedo, A. (2016). Notas sobre la biología del tiburón azul Prionace glauca (Carcharhiniformes: Carcharhinidae) en aguas ecuatorianas. Revista Mexicana de Biodiversidad. Disponible en: http://dx.doi.org/10.1016/j.rmb.2016.09.007
- Cailliet, G.; Martin, L.; Harvey, J.; Kusher, D. y Welden, B. (1983). Preliminary studies on the age and growth of blue (Prionace glauca), common thresher (Alopias vulpinus), and shortfin mako (Isurus oxyrinchus) sharks from California waters. En: E. D. Prince y M. Pulos (eds.), Proceedings, international workshop on age determination.
- Cañedo-Apolaya, R.; Ortiz-Álvarez, C.; Alfaro-Córdova, E.; Alfaro-Shigueto, J.; Vélez Zuazo, X.; Mangel, J.; Siccha-Ramírez, R.; Yamashiro, C. y Ramírez, J. (2021). Species Delimitation of Southeast Pacific Angel Sharks (Squatina spp.) Reveals Hidden Diversity through DNA Barcoding. Diversity, 13, 177-192.
- Casper, B.; Domingo, A.; Gaibor, N.; Heupel, M.; Kotas, E.; Lamónaca, A.; Pérez-Jimenez, J.; Simpfendorfer, C.; Smith, W.; Stevens, J.; Soldo, A. y Vooren, C. (2005). Sphyrna zygaena. The IUCN Red List of Threatened Species 2005: e T39388A10193797. Disponible en: http://dx.doi.org/10.2305/IUCN.UK.2005.RLTS.T39388A10193797.en
- Castañeda, J. (2001). Biología y pesquería del tiburón martillo (Sphyrna zygaena) en Lambayeque, 1991-2000. Informe Progresivo del Instituto del Mar del Perú, 139: 17-31.
- Castro, J. y Mejuto, J. (1995). Reproductive parameters of blue shark Prionace glauca, and other sharks in the Gulf of Guinea. Marine and Freswater Research, 46: 967-973.
- CeDePesca (2018). Programa Privado de Observadores a Bordo. Pesquería de anchoveta peruana para Consumo Humano Indirecto CHI. Informe Técnico N°1, mayo 2017- junio 2018.
- Céspedes Madalengoitia, C. (2014). Captura incidental de fauna marina en la pesquería de Merluccius gayi peruanus: Análisis y recomendaciones para su mitigación. Tesis para optar el grado de Magister Scientia. Universidad Nacional Agraria La Molina, 90 pp.
- Chirichigno, N. y Cornejo, M. (2001). Catálogo comentado de los peces marinos del Perú. Instituto del Mar del Perú. Callao. Publicación Especial, abril, 314 pp.
- Cisneros-Montemayor, A.; Barnes-Mauthe, M.; Al-Abdulrazzak, D.; Navarro-Holm, E. y Sumaila, R. (2013). Global economic value of shark ecotourism: implications for conservation. Oryx, 47(3): 381-388. Disponible en: https://doi.org/10.1017/S0030605312001718
- Compagno, L. (2001). Sharks of the world. An annotated and illustrated catalogue of shark species known to date. Volume 2. Bullhead, Mackerel and Carpet Sharks (Heterodontiformes, Lamniformes and Orectolobiformes). FAO, Rome.
- Córdova, F.; Alfaro-Shigueto, J.; Mangel, J.; Acuña-Perales, N.; Coasaca, J.; Gonzalez- Pestana, A.; Alfaro, E.; Pingo, S.; Jimenez, A.; Benites, D. y Espinoza, M. (2016). La pesquería artesanal de elasmobranquios en la zona norte del Perú, caso redes de cortina. En P. A. Mejía-Falla y A. F. Navia, editores. Libro de resúmenes, V Encuentro colombiano sobre condrictios. Fundación Squalus, Cali.
- Cornejo, R.; Velez-Zuazo, X.; Gonzalez-Pestana, A.; Kouri, C. y Mucientes, G. (2015). An updated checklist of Chondrichthyes from the southeast Pacific off Peru. Check List 11: 1809.
- Doherty, P.; Alfaro-Shigueto, J. y Hodgson et al. (2014). Big catch, little sharks: Insight into Peruvian small-scale longline fisheries. Ecology and Evolution 4(12): 2375-2383.
- Dulvy, N.; Simpfendorfer, C.; Davidson, L.; Fordham, S.; Brutigam, A.; Sant, G. y Welch, D. (2017). Challenges and Priorities in Shark and Ray Conservation. Current Biology, 27(11): R565-R572.
- Elliot, W.; Paredes, F. y Bustamante, M. (1995). Biología y pesquería de tiburones de las Islas Lobos, Perú. Informe Progresivo Nro. 16: 5-22.
- Elliot, W.; Paredes, F. y Bustamante, M. (1996). II Prospección biológico-pesquera de tiburones al oeste de Las Islas Lobos, enero 1996. Informe Progresivo Nro. 41: 3-17.
- Elliot, W.; Paredes, F. y Bustamante, M. (1997a). Estudio biológico pesquero de tiburones frente a Callao y Pisco, marzo-abril 1996. Informe Progresivo Nro. 61: 3-13.
- Elliot, W.; Paredes, F. y Bustamante, M. (1997b). Estudio biológico pesquero de tiburones frente a Paita, marzo 1996. Informe Progresivo Nro. 56: 26-40.
- Estrella, C. (2007). Resultados generales de la segunda encuesta estructural de la pesquería artesanal en el litoral peruano – II Enepa 2004-2005. Instituto del Mar del Perú.
- Fischer, W.; Krupp, F.; Schneider, W.; Sommer, C.; Carpenter, K y Niem, V. (1995). Guía FAO para la identificación de especies para los fines de la pesca. Pacífico Centro Oriental. Volumen II. Vertebrados Parte 1. Roma, FAO. Volumen II: 647-1200 pp.
- Food and Agriculture Organization – FAO (2005). National Aquaculture Sector Overview. Visión general del sector acuícola nacional – Perú. National Aquaculture Sector Overview Fact Sheets. Texto de Soto Cárdenas, G. I. In: Departamento de Pesca y Acuicultura de la FAO (en línea). Roma. Updated 1 February, 2005.
- Food and Agriculture Organization – FAO (2020). Fisheries and aquaculture software. FishStatJ – Software for Fishery and Aquaculture Statistical Time Series. In: FAO Fisheries and Aquaculture Department (online). Rome. Updated 21 July, 2016. Cited 6 August, 2020.
- Food and Agriculture Organization – Fisheries Global Information System – FAO-FIGIS (2005). A world overview of species of interest to fisheries. Chapter: Squatina californica. Retrieved on 8 July, 2005, from www.fao.org/figis/servlet/species?fid=15418. 2 p. FIGIS Species Fact Sheets. Species Identification and Data Programme-SIDP, FAO-FIGIS.
- Friedrich, L.; Jefferson, R. y Glegg, G. (2014). Public perceptions of sharks: Gathering support for shark conservation. Marine Policy 47 (2014) 1-7. Disponible en: https://doi.org/10.1016/j.marpol.2014.02.003
- Garla, R.; Freitas, R.; Janaina, C.; Carvalho, A. y Brant, G. (2015). Public awareness of the economic potential and threats to sharks of a tropical oceanic archipelago in the western South Atlantic. Marine Policy 60 (2015) 128-133. Disponible en: https://doi.org/10.1016/j.marpol.2015.06.012
- González-Pestana, A. (2014). Ecología trófica y áreas de crianza del tiburón martillo Sphyrna zygaena (Linnaeus 1758), juvenil en la zona norte de Perú. Tesis para optar la Licenciatura en Biología Marina y Eco Negocios. Universidad Científica del Sur. 92 pp.
- González-Pestana, A.; Kouri, C. y Velez-Zuazo, X. (2016). Shark fisheries in the Southeast Pacific: A 61-year analysis from Peru. (version 2; peer review: 1 approved, 2 approved with reservations). F1000Research 2016, 3: 164. Disponible en: https://doi.org/10.12688/f1000research.4412.2
- González-Pestana, A.; Alfaro-Shigueto, J.; Mangel, J. y Espinoza, P. (2017). Niveles de mercurio en el tiburón martillo Sphyrna zygaena (Carcharhiniformes: Sphyrnidae) del norte del Perú. Revista Peruana de Biología 24(4): 407-411.
- Gonzalez-Pestana, A.; Maguiño, R; Mendoza, A.; Kelez, S. y Ramírez-Macías, D. (2020). Distribution of whale shark (Rhincodon typus) off northern Peru based on habitat suitability. Aquatic Conservation Marine and Freshwater Ecosystem 2020; 1-12. Disponible en: https://doi.org/10.1002/aqc.3330
- Hall, M. y Roman, M. (2013). Bycatch and non-tuna catch in the tropical tuna purse seine fisheries of the world. FAO Fisheries and Aquaculture Technical Paper Nro. 568. Rome, FAO. 249 pp.
- Hearn, A.; Green, J.; Román, M.; Acuña-Marrero, D.; Espinoza, E. y Klimley, A. (2016). Adult female whale sharks make long-distance movements past Darwin Island (Galapagos, Ecuador) in the Eastern Tropical Pacific. Marine Biology, 163:214. Disponible en: https://doi.org/10.1007/s00227-016-2991-y
- Instituto del Mar del Perú – Imarpe (2015). Evaluación poblacional del Tiburón Martillo Sphyrna zygaena en el Mar Peruano durante el período 1996-2014.
- Instituto Nacional de Estadística e Informática – INEI (2012). Primer Censo Nacional de la Pesca Artesanal del Ámbito Marítimo (I Cenpar). Lima: Instituto Nacional de Estadística e Informática y Ministerio de la Producción.
- Joung, S. y Hsun Hsu, H. (2005). Reproduction and Embryonic Development of the Shortfin Mako, Isurus oxyrinchus Rafinesque, 1810, in the Northwestern Pacific. Zoological Studies 44(4): 487-496.
- Kanagusuku, K.; Vitor, M. y Lazarte, P. (2016). Comparación morfológica de los dentículos dérmicos del «tollo con bandas» Mustelus mento y del «tollo común» Mustelus whitneyi (Elamobranchii: Triakidae). Page 331 in W. Carbajal, J. Chanamé, E. Angulo, and J. Fupuy, editors. Libro de resúmenes. V Congreso de Ciencias del Mar del Perú. Lambayeque, Perú.
- Kehrig, H.; Baptista, G.; Di Beneditto, A.; Almeida, M.; Rezende, C.; Siciliano S.; De Moura, J. y Moreira, I. (2017). Biomagnificación de mercurio en la cadena trófica del Delfín Moteado del Atlántico (Stenella frontalis), usando el isótopo estable de nitrógeno como marcador ecológico. Revista de Biología Marina y Oceanografía, 52(2): 233-244.
- Kelez, S.; Velez-Zuazo, X.; Manrique, C.; Ayala, L.; Amoros, S. y Sanchez, S. (2008). Captura incidental de tortugas marinas en la pesca con palangre en Perú. Pages 59-61 in S. Kelez, F. van Oordt, N. de Paz, y K. Forsberg, editores. Libro de resúmenes. II Simposio de tortugas marinas en el Pacífico Sur Oriental.
- Kelez, S.; Maguiño, R.; Mendoza, A. y Caldas, O. (2019). Primeros reportes del tiburón boquiancho Megachasma pelagios (Chondrichtyes: Lamniformes: Megachasmidae) en Perú. II Simposio Peruano de Tiburones Rayas y Especies Afines.
- Kyne, P.; Cevallos, A.; Hernández, S. y Ebert, D. (2021). Triakis acutipinna. The IUCN Red List of Threatened Species 2021: e.T39361A124406514. Disponible en: https://dx.doi.org/10.2305/IUCN.UK.2021-1.RLTS.T39361A124406514.en. Accessed on 29 April 2022.
- López de la Lama, R.; De la Puente, S. y Riveros, J. (2018). Attitudes and misconceptions towards sharks and shark meat consumption along the Peruvian coast. PLoS ONE 13(8): e0202971. Disponible en https://doi.org/10.1371/journal.pone.0202971
- Maguiño, R.; Mendoza, A.; Kelez, S.; Velez-Zuazo, X. y Ramirez, D. (2018). Northern Peru becomes the new aggregation area for whale sharks. International Marine Conservation Congress 5.
- Maguiño, R.; Mendoza, A.; Kelez, S. y Ramírez, D. (2019a). El norte de Perú se convierte en una nueva área de agregación para los tiburones ballena. Primer Congreso Latinoamericano de Tiburones, Rayas y Quimeras y VIII Simposium Nacional de Tiburones y Rayas, México.
- Maguiño, R.; Flores García, R.; Sanjinez Medina, M.; Talledo Peña, G. y Kelez, S. (2019b). Pesquería y comercialización del tiburón angelote (Squatina californica) en Perú. II Simposio Peruano de Tiburones, Rayas y Especies Afines, Perú.
- Marín A, Serna J, Robles C, Ramírez B, Reyes-Flores LE, Zelada-Mázmela E, et al. (2018). A glimpse into the genetic diversity of the Peruvian seafood sector: Unveiling species substitution, mislabeling and trade of threatened species. PLoS ONE 13, e0206596. Disponible en: https://doi.org/g2zr
- McAllister, M.; Pikitch, E. y Babcock, E. (2008). Why are Bayesian methods useful for the stock assessment of sharks? Chapter 31: 351-368. In: Camhi, M.D, Pikitch, E.K. and Babcock, E.A. (Eds.) Sharks of the Open Ocean: Biology, fisheries and conservation. Blackwell Publishing Ltd., Oxford (UK). 502p.
- Moreno, J.; Parajúa, J y Morón, J. (1989). Biología reproductiva y fenología de Alopias vulpinus (Bonnaterre, 1788), Squaliformes: Alopiidae, en el Atlántico nororiental y Mediterráneo occidental. Scientia Marina 53(1): 37-46.
- Muter, B.; Gore, M.; Gledhill, K.; Lamont, C. y Huveneers, C. (2012). Australian and U.S. News Media Portrayal of Sharks and Their Conservation. Conservation Biology, Volume 27, No. 1, 187–196. Society for Conservation Biology. Disponible en: https://doi.org/10.1111/j.1523-1739.2012.01952.x
- Nakano, H. y Stevens, J. (2008). The biology and ecology of the blue shark Prionace glauca. In: Camhi M., Pikitch E., Babcock E. (Eds). Sharks of the Open Ocean: Biology, Fisheries and Conservation. Blackwell Publishing, Oxford, UK, 140-148 pp.
- Oceana (2018). “Llámalos por su nombre: sustitución de especies en la venta y consumo de pescados”. Disponible en: https://peru.oceana.org/sites/default/files/oceana_sustitucion_de_especies.pdf
- Pellón, J. y Cárdenas, G. (2014). Pesca de atunes y captura incidental por buques de palangre en aguas peruanas y áreas adyacentes. Informe del Instituto de Mar del Perú, 41: 215-216.
- PEW Environment Group (2012). Navigating Global Shark Conservation: Current Measures and Gaps.
- Prieto, G. (2015). Gramalote: Domestic Life, Economy and Ritual Practices of a Prehispanic Maritime Community. Doctoral Dissertation. Department of Anthropology, Yale University, New Haven, CT. (USA). 1221 pp.
- Ministerio de la Producción – Produce (2002). Reglamento del Ordenamiento Pesquero del Atún. Decreto Supremo 032-2003-PRODUCE.
- Ministerio de la Producción – Produce (2014). Plan de Acción Nacional para la Conservación y Ordenamiento de Tiburones, Rayas y Especies Afines. Decreto Supremo 002-2014-PRODUCE.
- Ministerio de la Producción – Produce (2017). Prohíben la extracción de la especie tiburón ballena, en aguas marinas de la jurisdicción peruana, así como su desembarque, transporte, retención, transformación y comercialización. Resolución Ministerial 331-2017-PRODUCE.
- Queiroz, N.; Humphries, N.; Noble, L.; Santos, A. y Sims, D. (2012). Spatial Dynamics and Expanded Vertical Niche of Blue Sharks in Oceanographic Fronts Reveal Habitat Targets for Conservation. PloS ONE 7: e32374.
- Ribot Carballal, M.; Galván Magaña, F. y Quiñonez Velázquez, C. (2005). Age and growth of the shortfin mako shark Isurus oxyrinchus from the western coast of Baja California Sur, Mexico. Fisheries Research, 76(1): 14-21. DOI: 10.1016/j.fishres.2005.05.004. Disponible en: https://bit.ly/3OcAGEg
- Rigby, C.; Barreto, R.; Carlson, J.; Fernando, D.; Fordham, S.; Francis, M.; Herman, K.; Jabado, R.; Liu, K.; Marshall, A.; Pacoureau, N.; Romanov, E.; Sherley, R. y Winker, H. (2019). Carcharhinus longimanus. The IUCN Red List of Threatened Species 2019: e.T39374A2911619. Disponible en: https://dx.doi.org/10.2305/IUCN.UK.2019-3.RLTS.T39374A2911619.en. Accessed on 29 April 2022.
- Romero, M. (2007). Mustelus whitneyi. The IUCN Red List of Threatened Species 2007: e.T63129A12619394. Disponible en: http://dx.doi.org/10.2305/IUCN.UK.2007.RLTS.T63129A12619394.en
- Romero, M. y Bustamante, M. (2007). Estudio de Tiburones con Fines de Conservación y Uso sostenible. En: Informe Anual 2007. Dirección de Investigaciones de recursos demersales y litorales. Unidad de Investigaciones en biodiversidad. Instituto del Mar del Perú.
- Serena, F.; Abella, A.; Bargnesi, F.; Barone, M.; Colloca, F.; Ferretti, F.; Fiorentino, F.; Jenerette, J. y Moro, S. (2020). Species diversity, taxonomy and distribution of Chondrichthyes in the Mediterranean and Black Sea. The European Zoological Journal, 87, 497-536.
- Shiffmann, D. y Hammerschlag, N. (2016). Shark conservation and management policy: a review and primer for non-specialists. Animal Conservation, 19(5): 401-412.
- Shiga, B.; Tapia, F., Forsberg, K.; Pino, J.; Purizaca, W.; Escalante, M.; Cañedo, R.; Moya, D.; Gore, M.; Thorburn, J.; Williams, A.; Mair, H.; Ormond, R. y Henry, L. (2016). Estado reproductivo del Tiburón martillo (Sphyrna zygaena) obtenido de la pesca artesanal en el norte de Perú. Page 145 in W. Carbajal, J. Chanamé, E. Angulo, and J. Fupuy, editors. Libro de resúmenes. V Congreso de Ciencias del Mar del Perú. Lambayeque, Perú.
- Simpfendorfer, C. y Dulvy, N. (2017). Bright spots of sustainable shark fishing. Current Biology, 27(3): R97-R98.
- Simpfendorfer, C.; Heupel, M.; White, W. y Dulvy, N. (2011). The importance of research and public opinion to conservation management of sharks and rays: a synthesis. Marine and Freshwater Research, 62(6): 518-527.
- Walker, T.; Rigby, C.; Pacoureau, N.; Ellis, J.; Kulka, D.; Chiaramonte, G. y Herman, K. (2020). Galeorhinus galeus. The IUCN Red List of Threatened Species 2020: e.T39352A2907336. Disponible en: https://dx.doi.org/10.2305/IUCN.UK.2020-2.RLTS.T39352A2907336.en. Downloaded on 10 August, 2020.